题目内容
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)以甲烷为原料可制得氢气。图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量(KJ)变化示意图,写出该反应的热化学方程式_______________(△H用E1、E2、E3表示)。

(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
A.容器内气体压强保持不变
B.吸收y mol H2只需1 mol MHx
C.若降温,该反应的平衡常数增大
D.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-![]() FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH-)降低的区域在__________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_____________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c( Na2FeO4)低于最高值的原因:_____________。
(5)在容积可变的密闭容器中充入10molCO和20molH2,发生CO ( g ) + 2H2 ( g )![]() CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。
CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。

【答案】(1)污染小;可再生;来源广;资源丰富;燃烧热值高(任写其中2个)(2分);
H2+2OH-+2e-=2H2O(2分)(2)CH4(g)+H2O(g)═CO(g)+3H2(g) △H=3(E2-E1)kJ·mol-1
(3)ac(2分) (4)①阳极室(1分) ②防止Na2FeO4与H2反应使产率降低 (1分)
③N点:c(OH)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。(2分) (5)0.2L(2分)
【解析】
试题分析:(1)与汽油相比,氢气作为燃料的优点有污染小;可再生;来源广;资源丰富;燃烧热值高等,碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O;
(2)根据图像可知生成物总能量高于反应物总能量,反应是吸热反应,则热化学方程式为 CH4(g)+H2O(g)═CO(g)+3H2(g) △H=3(E2-E1)kJ·mol-1。
(3)MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。A.平衡时气体的物质的量不变,压强不变,正确;B.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;C.降低温度,平衡向正反应方向移动,平衡常数增大,正确;D.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误;答案选ac;
MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。A.平衡时气体的物质的量不变,压强不变,正确;B.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;C.降低温度,平衡向正反应方向移动,平衡常数增大,正确;D.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误;答案选ac;
(4)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH)降低的区域在阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。
(5)当达到平衡状态A 时,CO转化率是0.5,则消耗CO是5mol,氢气是10mol,生成甲醇是5mol,剩余CO和氢气分别是5mol、10mol,则该温度下平衡常数K=![]() ;平衡状态B时CO中的转化率是0.8,则消耗CO是8mol,氢气是16mol,生成甲醇是8mol,剩余CO和氢气分别是2mol、4mol,则
;平衡状态B时CO中的转化率是0.8,则消耗CO是8mol,氢气是16mol,生成甲醇是8mol,剩余CO和氢气分别是2mol、4mol,则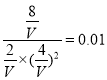 ,解得V=0.2L,即在平衡状态B时容器的体积V(B)=0.2L。
,解得V=0.2L,即在平衡状态B时容器的体积V(B)=0.2L。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案