题目内容
(共4分)25℃时,PH = 10.0的KOH溶液中,由水电离出的(OH-)=____________mol/L;
pH = 12.0的KCN溶液中,由水电离出来的(H+)=______________mol/L。
pH = 12.0的KCN溶液中,由水电离出来的(H+)=______________mol/L。
10-10 ; 10-2
考查pH的有关计算。
在pH=10.0的氢氧化钾溶液中,氢离子浓度是10-10mol/L,由于氢氧化钾是抑制水的电离的,所以溶液中由水电离出的OH-浓度也是10-10mol/L;在pH = 12.0的KCN溶液中,溶液中OH-浓度是10-2mol/L。由于KCN是促进水的电离的,所以由水电离出来的(H+)=10-2mol/L。
在pH=10.0的氢氧化钾溶液中,氢离子浓度是10-10mol/L,由于氢氧化钾是抑制水的电离的,所以溶液中由水电离出的OH-浓度也是10-10mol/L;在pH = 12.0的KCN溶液中,溶液中OH-浓度是10-2mol/L。由于KCN是促进水的电离的,所以由水电离出来的(H+)=10-2mol/L。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
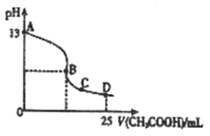
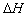 的绝对值均正确)( )
的绝对值均正确)( ) kJ/mol(燃烧热)
kJ/mol(燃烧热) kJ/mol(中和热)
kJ/mol(中和热) kJ/mol(反应热)
kJ/mol(反应热) kJ/mol(反应热)
kJ/mol(反应热) 57.3 kJ/mol
57.3 kJ/mol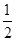 H2 SO4(aq)=
H2 SO4(aq)= O2(g)=8CO2(g)+9H2O△H=
O2(g)=8CO2(g)+9H2O△H=