题目内容
下列对离子方程式书写评价正确的是( )
| 选项 | 化学反应与离子方程式 | 评价 | |||||||||||||
| A | 将铜屑加入Fe3+溶液中:Fe3++Cu
|
正确 | |||||||||||||
| B | Na2O2与H2O反应Na2O2+H2O
|
错误,氧元素不守恒 | |||||||||||||
| C | NaOH溶液与氧化铝反应:Al2O3+2OH-
|
错误,产物应该是Al(OH
| |||||||||||||
| D | 向Fe(OH
|
正确 |
分析:A、选项中 离子方程式电荷不守恒;
B、原子不守恒;
C、氧化铝是两性氧化物溶于氢氧化钠生成偏铝酸钠;
D、硝酸具有强氧化性能氧化亚铁离子;
B、原子不守恒;
C、氧化铝是两性氧化物溶于氢氧化钠生成偏铝酸钠;
D、硝酸具有强氧化性能氧化亚铁离子;
解答:解:A、将铜屑加入Fe3+溶液中反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;故A错误;
B、选项中的离子方程式错误,原子不守恒,正确的离子方程式应为:2Na2O2+2H2O=4Na++4OH-+O2↑故B正确;
C、氧化铝是两性氧化物溶于氢氧化钠生成偏铝酸钠,正确的离子方程式,Al2O3+2OH-=AlO2-+H2O,故C错误;
D、硝酸可以氧化亚铁离子为三价铁离子,3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O,故离子方程式和评价都错误;故D错误;
故选B.
B、选项中的离子方程式错误,原子不守恒,正确的离子方程式应为:2Na2O2+2H2O=4Na++4OH-+O2↑故B正确;
C、氧化铝是两性氧化物溶于氢氧化钠生成偏铝酸钠,正确的离子方程式,Al2O3+2OH-=AlO2-+H2O,故C错误;
D、硝酸可以氧化亚铁离子为三价铁离子,3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O,故离子方程式和评价都错误;故D错误;
故选B.
点评:本题考查离子方程式书写原则的分析,正误判断方法,注意电荷守恒,原子守恒的应用,题目难度中等.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
下列对离子方程式书写评价正确的是
| 选项 | 化学反应与离子方程式 | 评价 |
| A | 将铜屑加入Fe3+溶液中:Fe3++Cu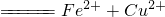 | 正确 |
| B | Na2O2与H2O反应Na2O2+H2O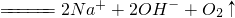 | 错误,氧元素不守恒 |
| C | NaOH溶液与氧化铝反应:Al2O3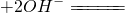 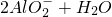 | 错误,产物应该是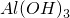 |
| D | 向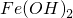 中加入足量稀硝酸: 中加入足量稀硝酸: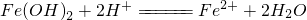 | 正确 |
- A.A
- B.B
- C.C
- D.D