题目内容
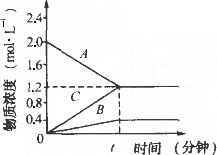
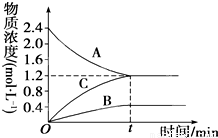
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间,试回答:(1)该反应的反应物是______;
(2)该反应的化学反应方程式是:______;
(3)若到达平衡状态的时间是2min,A物质的平均反应速率为______.

【答案】分析:(1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断.
(2)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式.
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v= 计算A物质的平均反应速率.
计算A物质的平均反应速率.
解答:解:(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物.
故答案为:A.
(2)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A?B+3C.
故答案为:2A?B+3C.
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,所v(A)=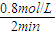 =0.4mol/(L?min).
=0.4mol/(L?min).
故答案为:0.4mol/(L?min).
点评:考查化学反应速率、浓度-时间图象等,注重基础,旨在考查学生对基础知识的掌握.
(2)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式.
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=
 计算A物质的平均反应速率.
计算A物质的平均反应速率.解答:解:(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物.
故答案为:A.
(2)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A?B+3C.
故答案为:2A?B+3C.
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,所v(A)=
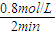 =0.4mol/(L?min).
=0.4mol/(L?min).故答案为:0.4mol/(L?min).
点评:考查化学反应速率、浓度-时间图象等,注重基础,旨在考查学生对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间,试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间,试回答: 如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间.试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间.试回答: