题目内容
某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如下图所示,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为( )
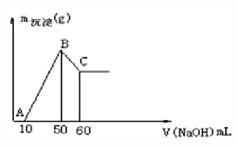

| A.1:1:1 | B.2:2:1 | C.2:1:1 | D.1:1:2 |
B
试题分析:加入氢氧化钠后,反应的离子方程式分别是H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O。所以根据图像可知,和氢离子反应的氢氧化钠是10ml,和氢氧化铝反应的氢氧化钠是10ml,则生成氢氧化铝消耗的氢氧化钠是30ml,所以和镁离子反应的氢氧化钠是10ml,因此溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为2:2:1,答案选B。+、Al3+、Mg2+三种阳离子和氢氧化钠反应的有关计算
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养和解题方法的指导。该题的关键是明确反应的原理和过程,以及图像的识别,有助于培养学生的逻辑思维能力和发散思维能力。

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
