题目内容
(1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是: ;
②写出由CaCl2通过化合反应制备CaCl的化学方程式: 。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是: ;
②写出由CaCl2通过化合反应制备CaCl的化学方程式: 。
(1)①常温下,浓硝酸可使铝表面形成致密的氧化膜而钝化(2分)
②4H2(g) + 2NO2(g)=N2(g) + 4H2O(g) △H=-1034 kJ·moL-1(3分)
(2)①HCl(1分) 2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑(3分)
②Ca + CaCl2=2CaCl(2分)
②4H2(g) + 2NO2(g)=N2(g) + 4H2O(g) △H=-1034 kJ·moL-1(3分)
(2)①HCl(1分) 2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑(3分)
②Ca + CaCl2=2CaCl(2分)
试题分析:(1)①常温下,铝在浓硝酸中钝化,表面形成致密的氧化膜而隔离铝和浓硝酸,所以可用铝制容器存放浓硝酸。
②首先携程H2与NO2反应的化学方程式并注明状态,然后根据盖斯定律求出?H,?H=2?H1-?H2=-1034 kJ·moL-1,可写出热化学方程式:4H2(g) + 2NO2(g)=N2(g) + 4H2O(g) △H=-1034 kJ·moL-1
(2)①反应物为CaCl2和H2,根据元素守恒,生成物乙显酸性,则乙为:HCl;化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,则H元素的质量分数为:1—52.29%—46.41%=1.3%,根据元素质量比可得该化合物的化学式为:CaHCl,与水反应生成H2的反应为:2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑
②Ca具有强还原性,可与CaCl2反应生成CaCl,化学方程式为:Ca + CaCl2=2CaCl

练习册系列答案
相关题目
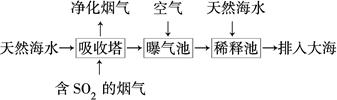
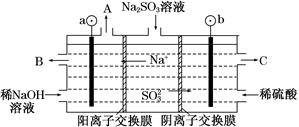

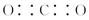
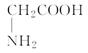
 是
是