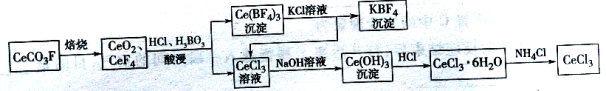
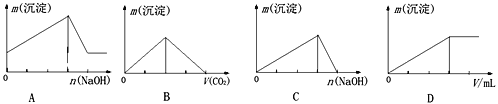
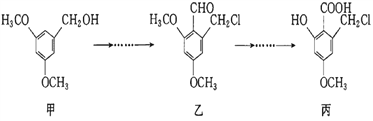
题目内容
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7),其主要反应为
①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
A. 反应①和②均为氧化还原反应
B. 反应①,转移4 mol电子时,被氧化的为O2为1mol
C. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
D. 生成1 mol Na2Cr2O7时共转移5 mol电子
【答案】C
【解析】分析:A、化学反应中有元素化合价变化的反应是氧化还原反应,没有化合价变化的化学反应不是氧化还原反应;
B、根据元素化合价变化判断;
C、得电子化合价降低的物质是氧化剂,失电子化合价升高的物质是还原剂;
D、反应只有O元素的化合价降低,由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,由方程式可知计算Na2CrO4与转移电子数,再换算为生成1mol的Na2Cr2O7时转移电子数。
详解:A、反应①中有元素化合价的变化,所以是氧化还原反应,而反应②中没有元素化合价的变化,所以不是氧化还原反应,A错误;
B、反应①的氧气中氧元素得电子化合价降低,发生得到电子的还原反应,氧气被还原,B错误;
C、反应①的氧气中氧元素得电子化合价降低,所以氧化剂是氧气,铁元素和铬元素失电子化合价升高,所以还原剂是FeOCr2O3,C正确;
D、由方程式4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2转移电子可知,生成1molNa2CrO4时,参加反应的O2的物质的量为7/8 mol,反应中O元素由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,转移电子的物质的量为7/8 mol×4=3.5mol,所以反应①中每生成1molNa2CrO4时电子转移3.5mol,反应②不是氧化还原反应,所以生成1molNa2Cr2O7时转移7mol电子,D错误;答案选C。
8Na2CrO4+2Fe2O3+8CO2转移电子可知,生成1molNa2CrO4时,参加反应的O2的物质的量为7/8 mol,反应中O元素由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,转移电子的物质的量为7/8 mol×4=3.5mol,所以反应①中每生成1molNa2CrO4时电子转移3.5mol,反应②不是氧化还原反应,所以生成1molNa2Cr2O7时转移7mol电子,D错误;答案选C。

 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案