题目内容
11.下列说法中不正确的是( )| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 一定条件下,将1 mol N2与3 mol H2充入密闭容器中充分反应可生成2 mol NH3 | |
| C. | 充电电池的化学反应原理是氧化还原反应 | |
| D. | Na2O和Na2O2晶体中阳离子与阴离子个数比均为2:1 |
分析 A.共价化合物仅含有共价键,离子化合物可含有共价键,一定含有离子键;
B.根据可逆反应的特点判断;
C.电池将化学能转变为电子,存在电子的转移;
D.Na2O由钠离子与氧离子构成、Na2O2由钠离子与过氧根离子构成.
解答 解:A.共价化合物仅含有共价键,离子化合物可含有共价键,一定含有离子键,为NaOH,含有离子键和共价键,为离子化合物,故A正确;
B.氮气和氢气的反应为可逆反应,不能完全反应,故B错误;
C.电池将化学能转变为电子,存在电子的转移,一定为氧化还原反应,故C正确;
D.Na2O由钠离子与氧离子构成、Na2O2由钠离子与过氧根离子构成,阴阳离子的个数比都是1:2,故Na2O和Na2O2晶体中阳离子与阴离子个数比均为2:1,故D正确.
故选B.
点评 本题考查较为综合,涉及化学键、可逆反应、化学能与电能的转化以及离子化合物等知识,为高考常见题型,侧重于学生的分析能力的考查,注意相关知识的积累,难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
1.下列有关实验的叙述,正确的是( )
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
2.下列关于硅原子的核外电子排布表示式(或排布图)中,错误的是( )
| A. | 1s22s22p63s23p2 | B. | [Ne]3s23p2 | ||
| C. | 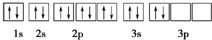 | D. |  |
19.在一个体积不变的密闭容器中发生可逆反应:A2(g)+B2(g)?2AB(g),达到平衡的标志是( )
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
3.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+=H2O | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
20.(1)25℃下,0.1mol/L醋酸pH为4,则此温下,该浓度醋酸的电离度为0.1%;电离平衡常数为10-7,水电离出的c(H+)=10-10mol/L,加少量水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小(填“增大”或“减小”)
(2)pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V3>V1=V2.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(3)下表是不同温度下水的离子积数据:
试回答下列问题:
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
(4)25℃时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则a的取值范围是$\frac{7}{2}$<a<$\frac{14}{3}$.
(2)pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL
①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V3>V1=V2.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
(3)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
(4)25℃时,若体积为Va,pH=a的某一元强酸与体积为Vb,pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则a的取值范围是$\frac{7}{2}$<a<$\frac{14}{3}$.
1.下列有关化学用语的表示方法中错误的是( )
| A. | CO2分子的结构式:O=C=O | |
| B. | S2-的结构示意图: | |
| C. | R2+离子核外有a个电子,b个中子,R原子符号为:${\;}_{a+2}^{a+b+2}$R | |
| D. | 次氯酸的电子式: |
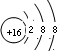 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为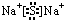 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.