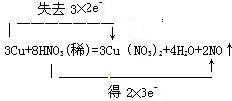题目内容
已知铜在常温下能被稀HNO3溶解,反应为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
(1)请将上述反应改写成离子方程式
(2)HNO3没有全部参加氧化还原反应,被还原的HNO3占总HNO3的
(1)请将上述反应改写成离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(2)HNO3没有全部参加氧化还原反应,被还原的HNO3占总HNO3的
25
25
%,若反应中生成1molNO,则反应中转移3NA
3NA
个e-,消耗Cu96
96
g.分析:(1)根据易溶于水的强电解质在水中以离子形式存在,单质、水、沉淀、气体不能拆分依此分析;
(2)根据方程可知,参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,根据化合价变化判断转移电子数;根据方程式计算铜的质量.
(2)根据方程可知,参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,根据化合价变化判断转移电子数;根据方程式计算铜的质量.
解答:解:(1)铜、一氧化氮、水在水中不会电离,硝酸在水中电离出氢离子和硝酸根离子,依据离子电荷守恒进行书写其离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)在氧化还原反应中,化合价降低的是氧化剂,发生的是还原反应,根据方程可知,参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,所以被还原的HNO3占总HNO3的25%;由HNO3生成NO,氮元素的化合价从+5价降低到+2价,转移3个电子,所以生成1molNO转移3mol,即3NA个电子;根据反应方程式可知生成1molNO,消耗1.5mol铜,所以铜的质量为m=nM=1.5mol×64g/mol=96g;
故答案为:25;3NA;96;
(2)在氧化还原反应中,化合价降低的是氧化剂,发生的是还原反应,根据方程可知,参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,所以被还原的HNO3占总HNO3的25%;由HNO3生成NO,氮元素的化合价从+5价降低到+2价,转移3个电子,所以生成1molNO转移3mol,即3NA个电子;根据反应方程式可知生成1molNO,消耗1.5mol铜,所以铜的质量为m=nM=1.5mol×64g/mol=96g;
故答案为:25;3NA;96;
点评:本题考查氧化还原反应以及离子方程式的书写,及根据方程式的有关计算,题目难度不大,注意从化合价的变化角度分子氧化还原反应的有关概念.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目