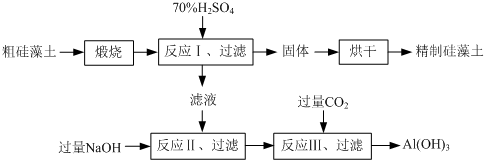
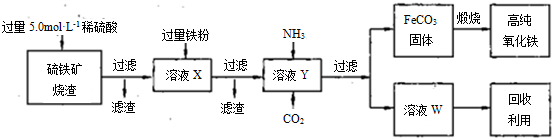
题目内容
实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀):

下列分析正确的是
A.用98%的浓硫酸配制溶解所用的4.5 mol·L-1的稀硫酸,只需3种玻璃仪器
B.步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量的氯气
C.利用Cu(OH)2 替代CuO也可调节溶液pH而不影响实验结果
D.步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、玻璃棒、酒精灯、泥三角、三脚架
【答案】
C
【解析】

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(7分)实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。
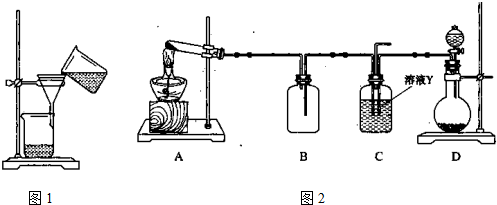
所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置:

(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液
e.碱石灰 f.品红溶液 g.湿润的红色石蕊试纸
|
制取气体 |
杂质气体 |
制取气体的发生装置 |
除去杂质气体的净化装置 |
收集装置 |
净化装置内 所用试剂 |
检验制得气体所用试剂 |
|
NH3 |
H2O(g) |
|
|
|
|
|