题目内容
 实验室可以利用图所示装置制取氧气.将3.9g过氧化钠放入烧瓶中,加入100毫升H2O,并用排水法收集气体.(不考虑液体体积变化)
实验室可以利用图所示装置制取氧气.将3.9g过氧化钠放入烧瓶中,加入100毫升H2O,并用排水法收集气体.(不考虑液体体积变化)(1)过氧化钠与水反应的化学方程式为:
(2)所得气体体积为(标准状况下):
(3)集气瓶充满气体后,简述取出集气瓶的操作方法
分析:(1)过氧化钠与水反应生成氢氧化钠和氧气,据此写出反应的化学方程式;
(2)根据反应方程式计算出生成氧气的物质的量及标况下的体积;
(3)根据正确取出水中集气瓶的操作方法进行解答.
(2)根据反应方程式计算出生成氧气的物质的量及标况下的体积;
(3)根据正确取出水中集气瓶的操作方法进行解答.
解答:解:(1)过氧化钠与水反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)3.9g过氧化钠的物质的量为:n(Na2O2)=
=0.05mol,根据反应2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气的物质的量为:n(O2)=
n(Na2O2)=0.025mol,标况下生成的氧气的体积为:22.4L/mol×0.025mol=0.56L,
故答案为:0.56L;
(3)集气瓶充满气体后,取出集气瓶的操作方法为:用玻璃片在水面下盖住集气瓶口将玻璃片与集气瓶一起移出水面将盖有玻璃片的集气瓶正放在实验台上,
故答案为:用玻璃片在水面下盖住集气瓶口将玻璃片与集气瓶一起移出水面将盖有玻璃片的集气瓶正放在实验台上.
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)3.9g过氧化钠的物质的量为:n(Na2O2)=
| 3.9g |
| 78g/mol |
| 1 |
| 2 |
故答案为:0.56L;
(3)集气瓶充满气体后,取出集气瓶的操作方法为:用玻璃片在水面下盖住集气瓶口将玻璃片与集气瓶一起移出水面将盖有玻璃片的集气瓶正放在实验台上,
故答案为:用玻璃片在水面下盖住集气瓶口将玻璃片与集气瓶一起移出水面将盖有玻璃片的集气瓶正放在实验台上.
点评:本题考查了过氧化钠的化学性质,涉及了简单的化学计算、化学方程式书写,题目难度中等,注意掌握钠及其化合物的性质,明确过氧化钠与水、二氧化碳反应的化学方程式;(3)考查了基本实验操作方法,为易错点,注意掌握正确的操作方法.

练习册系列答案
相关题目
 实验室可用如图所示的装置制取气体,下列有关说法正确的是( )
实验室可用如图所示的装置制取气体,下列有关说法正确的是( )| A、实验室不能用这种装置来制取氢气 | B、这种装置可以不用加热试管来检查装置的气密性 | C、食盐跟浓硫酸反应制氯化氢的实验能用这种装置 | D、利用这种装置制取乙炔可以随制随停 |
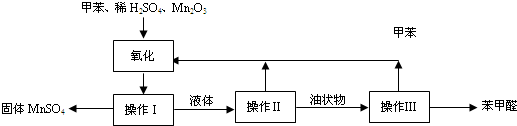
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:______.
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是______mL和______mol?L-1.
②分析实验______(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______.
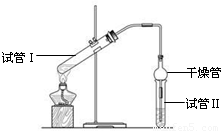
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:______.
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol?L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验______(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______.

 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.