题目内容
【题目】元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
A | |||||||||||||||||
D | F | ||||||||||||||||
G | Q | M | R | ||||||||||||||
N | |||||||||||||||||
(1)金属性最强的元素是 (填元素符号),写出表中所给元素中氧化物其氧化物具有两性的与同周期最高价氧化物对应水化物显碱性化合物之间的离子反应:_________
(2)元素的非金属性:M R(填“>”或“<”)。
(3)R的最高价氧化物对应水化物的化学式是 。
(4)F、G两元素形成的淡黄色固体物质的电子式为___________,该物质含有的化学键的类型是 ________ 。
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是 (填离子符号)。
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
(7)A与D形成分子的空间结构可能是(填序号) 。
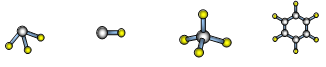
a b c d
【答案】![]() (1)K;Al2O3+2OH—=2AlO2—+H2O (2)< (3)HClO4
(1)K;Al2O3+2OH—=2AlO2—+H2O (2)< (3)HClO4
(4) ;离子键、非极性共价键
(5)S2—>Cl—>K+ (6)![]()
(7)c d
【解析】试题分析:根据元素在周期表中的分布,A是H、D是C、F是O、G是Na、Q是Al、M是S、R是Cl、N是K。(1)金属性最强的元素是K,氧化铝具有两性,同周期最高价氧化物对应水化物显碱性最强的是氢氧化钠,反应离子反应:Al2O3+2OH—=2AlO2—+H2O
(2)同周期从左到右非金属性增强,元素的非金属性:M<R。
![]() (3)Cl的最高价氧化物对应水化物的化学式是HClO4。
(3)Cl的最高价氧化物对应水化物的化学式是HClO4。
(4)F、G两元素形成的淡黄色固体物质是过氧化钠,电子式为 , ; 该物质含有的化学键的类型是离子键、非极性共价键。
(5)S、Cl、K原子可形成与Ar具有相同电子层结构的简单离子;这些离子的半径由大到小的顺序是S2—>Cl—>K+。
(6)O原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为![]() 。
。
(7)H与C形成甲烷分子的空间结构是c、苯的分子的空间结构是d 。



