��Ŀ����
����Ŀ��[��ѧ����ѡ�����ʽṹ������]
�±�Ϊ��ʽ���ڱ���һ���֣����е���Ŵ�����Ӧ��Ԫ�أ�

��1��д���ϱ���Ԫ����ԭ�ӵ���Χ�����Ų�ʽ ��
��2����Ԫ���������γɵ�ˮ����������廯�����У�Ԫ�������ӻ���ʽΪ �ӻ���Ԫ���������γɵĻ�����ľ��������� ��
��3��Ԫ�����ĵ�һ������ �� ������д����������=�������������ĵ�һ�����ܣ�Ԫ������Ԫ�����γɵ�X���ӵĿռ乹��Ϊ ����д����Ԫ�����ĵ��ʻ�Ϊ�ȵ�������ӡ����ӵĻ�ѧʽ ����дһ�֣���
��4���ڲⶨԪ���������γɻ��������Է�������ʱ��ʵ���õ�ֵһ���������ֵ����Ҫԭ���� ��
��5����������������Ӧ��ˮ����ϡ��Һ��Ԫ�����ĵ��ʷ�Ӧʱ��Ԫ��������ԭ����ͼۣ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
��6����������Xͨ�뺬��Ԫ��������ɫ��������Һ�У���Ӧ�����ӷ���ʽΪ ��Ԫ������ij��������ľ���ṹ��ͼ��ʾ������ʵ�����ʾԪ����ԭ�ӣ���һ������������������ԭ����ĿΪ ��

���𰸡���1��3d54s1��
��2��sp2�����Ӿ��壻
��3������������CO��C22����
��4��HF���Ӽ���γ������
��5��4Mg+10HNO3=4Mg��NO3��2+NH4NO3+3H2O��
��6��Cu2++2NH3H2O=Cu��OH��2��+2NH4+��2��
���������������������Ԫ�����ڱ��ṹ������ȷ����������������������������������������Ԫ�طֱ�Ϊ��H��Be��C��N��O��F��Mg��Cl��Cr��Cu��
��1������CrԪ�أ�ԭ������Ϊ24�����ݺ�������Ų�������д��
��2������CԪ�أ�����HԪ�أ��γɵ�ˮ����������廯��������ϩ���ӻ�����������ɹ¶Ե��ӶԺͳ�������
����MgԪ�أ�����ClԪ�أ����ý�������÷ǽ����γ����ӻ����
��3������NԪ�أ�����OԪ�أ�ͬ����Ԫ�ص�һ�����ܴ���������������ƣ�������ͬ��ԭ�ӹ����ȫ����������ȫ��ʱ��ϵ������ͣ�ԭ�ӽ��ȶ�����˼۵����Ų����ڰ����Ĺ����Ԫ�أ����һ�����ܱ��ٽ�ԭ�ӵĵ�һ�����ܴ�
Ԫ������Ԫ�����γɵ���NH3���ӣ������Σ�
ԭ����Ŀ�͵�����������۵�����������ͬ������Ϊ�ȵ����壬�ȵ�����������ƵĽṹ������
��4��F�ĵ縺�Դ�HF���Ӽ���γ������
��5������NԪ�أ�����������Ӧ��ˮ����ϡ��ҺΪϡ���ᣬ��Mg���ʷ�Ӧ��Mg�ǻ�ԭ����������ΪMg��NO3��2��ϡ��������������������ã������������������ñ���ԭΪNH4NO3��
��6������������ͭ��Һ��Ӧ������Cu��OH��2��ɫ��������ɫ��Ϊ��ԭ�ӣ����þ�̯��������һ������������������ԭ����Ŀ��
�⣺��1������CrԪ�أ�Cr��24��Ԫ�أ���ԭ�Ӻ�����24�����ӣ������������ԭ�������ع�����д���������Ų�ʽ��3d�ܼ�����������4s�ܼ�����������������4s����3d������еĵ��Ӵ���ȫ����������ȫ��ʱԭ�����ȶ�������Cr�ĺ�������Ų�ʽΪ1s22s22p63s23p63d54s1����Χ�����Ų�ʽ3d54s1��
�ʴ�Ϊ��3d54s1��
��2����ϩ����˫���͵���������̼̼˫����һ����������1��p��p�������������4��̼�����Ϊ������̼ԭ���ӻ������Ϊ3�����Բ���sp2�ӻ���ʽ��
���ý�������÷ǽ����γ����ӻ����Ԫ���������γɵĻ��������Ȼ�þ���������ӻ�����γ����Ӿ��壬
�ʴ�Ϊ��sp2�����Ӿ��壻
��3��������NԪ�أ���Χ�����Ų�ʽ2s22p3������OԪ�أ���Χ�����Ų�ʽ2s22p4����Ԫ�ش���ͬһ���ڣ���ԭ��ԭ��������NԪ��P�ܼ����ڰ������������ͣ�ԭ�ӽ��ȶ������һ��������ԭ�ӵĵ�һ�����ܴ�
Ԫ������Ԫ�����γɵ���NH3���ӣ�Nԭ�Ӳ�ȡsp3�ӻ�����һ�Թ¶Ե��Ӷԣ�����Ϊ�����Σ�
N2��2��ԭ�ӣ�14�����ӣ���10���۵��ӣ�����ȵ�����ΪCO��C22���ȣ�
�ʴ�Ϊ�����������Σ�CO��C22����
��4��F�ĵ縺�Դ�HF���Ӽ���γ������ʵ���õ�ֵһ���������ֵ���ʴ�Ϊ��HF���Ӽ���γ������
��5��Mg��ϡ���ᷴӦ����ʽΪ4Mg+10HNO3=4Mg��NO3��2+NH4NO3+3H2O���ʴ�Ϊ��4Mg+10HNO3=4Mg��NO3��2+NH4NO3+3H2O��
��6������������ͭ��Һ��Ӧ������Cu��OH��2��ɫ��������Ӧ���ӷ���ʽΪCu2++2NH3H2O=Cu��OH��2��+2NH4+��
��ɫ��Ϊ��ԭ�ӣ�����һ������������������ԭ����ĿΪ1+8��![]() =2��
=2��
�ʴ�Ϊ��Cu2++2NH3H2O=Cu��OH��2��+2NH4+��2��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��Ԫ�����ڱ���ѧϰ���ʽṹ�����ʵ���Ҫ���ߣ���ͼ��Ԫ�����ڱ���һ���֣�����������ĸA��D��F��G��Q��M��R��N��T�ֱ����ij�ֻ�ѧԪ�ء���������9��Ԫ�ػش��������⡣
A | |||||||||||||||||
D | F | ||||||||||||||||
G | Q | M | R | ||||||||||||||
N | |||||||||||||||||
��1����������ǿ��Ԫ���� ����Ԫ�ط��ţ���д����������Ԫ������������������������Ե���ͬ��������������Ӧˮ�����Լ��Ի�����֮������ӷ�Ӧ��_________
��2��Ԫ�صķǽ����ԣ�M R������>������<������
��3��R������������Ӧˮ����Ļ�ѧʽ�� ��
��4��F��G��Ԫ���γɵĵ���ɫ�������ʵĵ���ʽΪ___________�������ʺ��еĻ�ѧ���������� ________ ��
��5������ijЩԪ�ص�ԭ�ӿ��γ���Ar������ͬ���Ӳ�ṹ�ļ����ӣ���Щ���ӵİ뾶�ɴ�С��˳���� �������ӷ��ţ���
��6������ijԪ��ԭ�ӵĺ�����Ӳ�����������������3������Ԫ�ص�ԭ�ӽṹʾ��ͼΪ ��
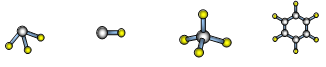
��7��A��D�γɷ��ӵĿռ�ṹ�����ǣ�����ţ� ��
a b c d