题目内容
9.下列叙述正确的是( )①配位键在形成时,是由成键双方各提供一个电子形成共用电子对
②C60晶体的晶胞是面心立方结构
③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素
④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子
⑤冰中存在极性共价键和氢键两种化学键的作用
⑥Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中
⑦熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体
⑧氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为

| A. | ②⑥ | B. | ②③ | C. | ⑤⑥ | D. | ③⑥ |
分析 ①含有空轨道和含有孤电子对的原子之间易形成配位键;
②根据晶胞 判断;
判断;
③根据最后排入电子名称确定元素在周期表中所属区名称;
④H2O2是极性分子;
⑤氢键不是化学键;
⑥氢氧化铜和氨水反应生成络合物;
⑦HgCl2的稀溶液有弱的导电能力,说明是弱电解质;
⑧氢键应形成于X…H-Y形式当中,X、Y必须是N、O、F元素之一.这样就有两种可能:(1)H3N…H-O-H;(2)H2N-H…OH2;再根据氨水的电离分析.
解答 解:①配位键在形成时,是由成键双方一个提供空轨道、一个提供孤电子对形成的,故错误;
②C60晶体的晶胞是 ,为面心结构,故正确;
,为面心结构,故正确;
③根据最后排入电子名称确定元素在周期表中所属区名称,Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]3d104s24p2,属于P区元素,故错误;
④H2O2结构不对称,属于极性分子,故错误;
⑤氢键不是化学键,故错误;
⑥氢氧化铜和氨水反应生成络合物离子银氨离子,所以氢氧化铜能溶于氨水中,故正确;
⑦HgCl2的稀溶液有弱的导电能力,说明是弱电解质,故错误;
⑧氢键应形成于X…H-Y形式当中,X、Y必须是N、O、F元素之一.这样就有两种可能:(1)H3N…H-O-H;(2)H2N-H…OH2;由于一水合氨可电离出NH4+和OH-,所以(1)结构是合理的.如果是(2)则应电离出NH2-和H3O,故错误;
故选A.
点评 本题考查了化学键的有关知识,涉及氢键、配位键等,知道配位键的形成、氢键对物质溶解性的影响等知识点,题目难度不大.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
20.取少量某有机物分别进行如下实验,结果是①能使酸性高锰酸钾溶液褪色;②与水混合静置后分层;③加入滴有酚酞试液的强碱,共热后酚酞变无色.此有机物是( )
| A. | 乙酸钠 | B. | 油酸甘油酯 | C. | 乙酸乙酯 | D. | 甲苯 |
17.4月22日是世界地球日,我国今年的地球日主题为:珍惜地球资源,转变发展方式,提高资源利用效益.下列有关做法与此不相符的是( )
| A. | 建立废旧电池回收站,对其进行回收再利用 | |
| B. | 将木材边角料制成木屑颗粒,用作环保能源 | |
| C. | 露天焚烧农作物秸秆还田,用作农作物肥料 | |
| D. | 部分煤炭转直接开采为先在地下气化或液化 |
14.下列反应不属于可逆反应的是( )
| A. | 工业上利用氮气和氢气合成氨气 | |
| B. | 水电解生成氢氧混和气体和氢氧混和气体爆炸生成水 | |
| C. | 密闭容器中的二氧化氮和四氧化二氮在一定压力下可以相互转化 | |
| D. | 密闭容器中的二氧化硫和氧气在一定的条件下可以生成三氧化硫,同时三氧化硫又可以分解为二氧化硫和氧气 |
18.在800℃下测定反应2NO+2H2═N2+2H2O的反应物初始浓度及反应的初速率,所得数据如表所示
下列分析实验数据所得的结论中不正确的是( )
| 实验标号 | 初始浓度/mol•L-1 | 生成N2的初速率/mol•L-1•s-1 | |
| c(NO) | c(H2) | ||
| 1 | 6.00×10-3 | 1.00×10-3 | 3.19×10-3 |
| 2 | 6.00×10-3 | 2.00×10-3 | 6.38×10-3 |
| 3 | 6.00×10-3 | 3.00×10-3 | 9.57×10-3 |
| 4 | 1.00×10-3 | 6.00×10-3 | 0.48×10-3 |
| 5 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
| 6 | 3.00×10-3 | 6.00×10-3 | 4.32×10-3 |
| A. | 增大c(H2),生成N2的初速率增大 | B. | 减小c(NO),生成N2的初速率减小 | ||
| C. | 生成N2的初速率与c(H2)成正比 | D. | 生成N2的初速率与c(NO)成正比 |
19.下列有关化学用语、概念的表述中正确的是( )
| A. | 氢氧化钡溶液与硫酸铜溶液反应的离子方程式为Ba2++SO42-═BaSO4↓ | |
| B. | 氢气的燃烧热为285.8KJ/mol,所以表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H≈-571.6KJ/mol | |
| C. | 原子序数为1和8的两种元素形成的18电子的化合物的电子式为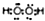 | |
| D. | 铜锌原电池的正极反应式一定为2H++2e-═H2↑ |
 某研究性小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
某研究性小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
 .
.


 +NaOH
+NaOH +NaCl+H2O
+NaCl+H2O +(2n-1)H2O
+(2n-1)H2O