ƒøƒ⁄»ð
°æƒø°øÀÊ‘≠◊”–Ú ˝µð‘ˆ£¨∞À÷÷∂Ã÷Ð∆⁄‘™Àÿ£®”√◊÷ƒ∏xµ»±Ì 棩‘≠◊”∞Îæ∂µƒœý∂‘¥Û–°°¢◊Ó∏þ’˝º€ªÚ◊ÓµÕ∏∫º€µƒ±‰ªØ»ÁÕºÀ˘ æ£Æ 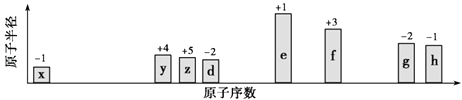
∏˘æð≈–∂œ≥ˆµƒ‘™Àÿªÿ¥Œ £∫
£®1£©y‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√ « £Æ
£®2£©±»Ωœd°¢e≥£º˚¿Î◊”µƒ∞Îæ∂¥Û–°£®”√ªØ—ß Ω±Ì æ£¨œ¬Õ¨£©£∫£ª±»Ωœg°¢hµƒ◊Ó∏þº€—ıªØŒÔ∂‘”¶Àƪ،ԵƒÀ·–‘«ø»ı £Æ
£®3£©»Œ—°…œ ˆ‘™Àÿ◊È≥…2÷÷Àƒ‘≠◊”π≤º€ªØ∫œŒÔ£¨–¥≥ˆ∆‰µÁ◊” Ω£∫£ª £Æ
£®4£©“—÷™1mol eµƒµ•÷ ‘⁄◊„¡ød2÷–»º…’£¨ª÷∏¥÷¡ “Œ¬£¨∑≈≥ˆ255.5kJ»»¡ø£¨–¥≥ˆ∏√∑¥”¶µƒ»»ªØ—ß∑Ω≥Ã Ω£∫ £Æ
°æ¥∞∏°ø
£®1£©µ⁄∂˛÷Ð∆⁄IVA◊Â
£®2£©O2©Å£æNa+£ªHClO4£æH2SO4
£®3£©![]() £ª
£ª![]()
£®4£©2Na£®s£©+O2£®g£©=Na2O2£®s£©°˜H=©Å511kJ?mol©Å1
°æΩ‚Œˆ°øΩ‚£∫¥”Õº÷–µƒªØ∫œº€°¢‘≠◊”∞Îæ∂µƒ¥Û–°º∞‘≠◊”–Ú ˝£¨ø…÷™x «H‘™Àÿ£¨y «C‘™Àÿ£¨z «N‘™Àÿ£¨d «O‘™Àÿ£¨e «Na‘™Àÿ£¨f «Al‘™Àÿ£¨g «S‘™Àÿ£¨h «Cl‘™Àÿ£Æ
£®1.£©y «C‘™Àÿ£¨‘⁄‘™Àÿ÷Ð∆⁄±ÌµƒŒª÷√ «µ⁄∂˛÷Ð∆⁄IVA◊£¨À˘“‘¥∞∏ «£∫µ⁄∂˛÷Ð∆⁄IVA◊£ª
£®2.£©µÁ◊”≤„Ω·ππœýÕ¨µƒ¿Î◊”£¨∫ÀµÁ∫… ˝‘Ω¥Û¿Î◊”∞Îæ∂‘Ω–°£¨π ¿Î◊”∞Îæ∂£∫O2©Å£æNa+£ª∑«Ω Ù–‘S£ºCl£¨∑«Ω Ù–‘‘Ω«ø£¨◊Ó∏þº€—ıªØŒÔÀƪ،ԵƒÀ·–‘‘Ω«ø£¨π À·–‘£∫HClO4£æH2SO4 £¨
À˘“‘¥∞∏ «£∫O2©Å£æNa+£ªHClO4£æH2SO4£ª
£®3.£©”…H∫ÕN‘™Àÿ◊È≥…“ª÷÷Àƒ‘≠◊”π≤º€ªØ∫œŒÔŒ™NH3 £¨ µÁ◊” ΩŒ™£∫ ![]() £¨”…H°¢O‘™Àÿ“ª÷÷Àƒ‘≠◊”π≤º€ªØ∫œŒÔŒ™H2O2 £¨ µÁ◊” ΩŒ™
£¨”…H°¢O‘™Àÿ“ª÷÷Àƒ‘≠◊”π≤º€ªØ∫œŒÔŒ™H2O2 £¨ µÁ◊” ΩŒ™ ![]() £¨
£¨
À˘“‘¥∞∏ «£∫ ![]() £ª
£ª ![]() £ª
£ª
£®4.£©ƒ∆‘⁄—ı∆¯÷–»º…’…˙≥…π˝—ıªØƒ∆£¨∑¥”¶∑Ω≥Ã ΩŒ™£∫2Na+O2 ![]() Na2O2 £¨ 2molƒ∆∑¥”¶∑≈≥ˆ∑≈≥ˆµƒ»»¡øŒ™255.5kJ°¡2=511kJ£¨∑¥”¶»»ªØ—ß∑Ω≥Ã ΩŒ™£∫2Na£®s£©+O2£®g£©=Na2O2£®s£©°˜H=©Å511kJmol©Å1 £¨
Na2O2 £¨ 2molƒ∆∑¥”¶∑≈≥ˆ∑≈≥ˆµƒ»»¡øŒ™255.5kJ°¡2=511kJ£¨∑¥”¶»»ªØ—ß∑Ω≥Ã ΩŒ™£∫2Na£®s£©+O2£®g£©=Na2O2£®s£©°˜H=©Å511kJmol©Å1 £¨
À˘“‘¥∞∏ «£∫2Na£®s£©+O2£®g£©=Na2O2£®s£©°˜H=©Å511kJmol©Å1 £Æ

 –°—ß∂·π⁄ABæÌœµ¡–¥∞∏
–°—ß∂·π⁄ABæÌœµ¡–¥∞∏ ABCøºÕı»´”≈æÌœµ¡–¥∞∏
ABCøºÕı»´”≈æÌœµ¡–¥∞∏


