题目内容
将11.9 g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下体积为3.36 L。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀19.4 g,则上述反应中生成NO气体的体积为(标准状况下)
| A.6.72 L | B.11.2 L | C.22.4 L | D.4.48 L |
A
试题分析:合金溶于足量的NaOH溶液中,金属铝和氢氧化钠反应产生气体氢气3.36L(标准状况)物质的量为
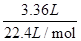 =0.15mol,根据电子转移守恒可知n(Al)=
=0.15mol,根据电子转移守恒可知n(Al)=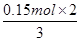 =0.1mol,故金属铝的质量为0.1mol×27g/mol=2.7g,金属铝提供电子的量是0.3mol。由题意可知,向反应后的溶液中加入过量NaOH溶液后,铝离子全部转化为偏铝酸根离子,不会出现沉淀,反应后产生19.4g氢氧化镁、氢氧化铁沉淀的,沉淀中氢氧根的质量为19.4g-(11.9g-2.7g)=10.2g,物质的量n(OH-)=
=0.1mol,故金属铝的质量为0.1mol×27g/mol=2.7g,金属铝提供电子的量是0.3mol。由题意可知,向反应后的溶液中加入过量NaOH溶液后,铝离子全部转化为偏铝酸根离子,不会出现沉淀,反应后产生19.4g氢氧化镁、氢氧化铁沉淀的,沉淀中氢氧根的质量为19.4g-(11.9g-2.7g)=10.2g,物质的量n(OH-)=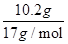 =0.6mol。反应中金属铁、铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量即0.6mol。将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共提供电子的物质的量为0.6+0.3=0.9mol,令NO的物质的量为xmol,根据电子转移守恒有(5-2)×xmol=0.9mol,解得x=0.3,所以生成的NO的体积为0.3mol×22.4L/mol=6.72L,故A正确。
=0.6mol。反应中金属铁、铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量即0.6mol。将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共提供电子的物质的量为0.6+0.3=0.9mol,令NO的物质的量为xmol,根据电子转移守恒有(5-2)×xmol=0.9mol,解得x=0.3,所以生成的NO的体积为0.3mol×22.4L/mol=6.72L,故A正确。
练习册系列答案
相关题目
 Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
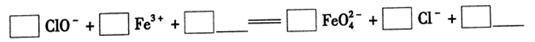
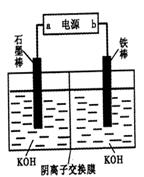
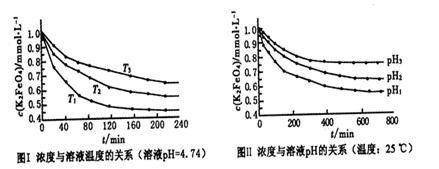
 Fe3O4+S4O62-+2H2O,有关说法正确的是
Fe3O4+S4O62-+2H2O,有关说法正确的是 2H2↑+O2↑,下列有关判断正确的是
2H2↑+O2↑,下列有关判断正确的是 CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。