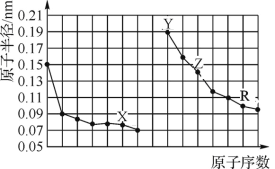
题目内容
【题目】第一代半导体材料(Si、Ge等)与第二代半导体材料(GaAs、InSb等)一起,将人类推进了信息时代。近年来,以碳化硅(SiC)、氮化镓(GaN)为代表的第三代半导体材料的出现,开辟了人类资源和能源节约型社会的新发展,也成为了科学家研究的热点。
(1)N、P、AS位于同一主族,基态氮原子的核外共有___种不同运动状态的电子,N2O的空间构型为_______。
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到广泛的应用,其结构如图所示,中心离子为钴离子。酞菁钻中碳原子的杂化轨道类型为___;与钴离子通过配位健结合的氮原子的编号是_______。

(3)C与N处于同周期相邻元素,C形成的一种重要物质可燃冰是天然气水合物,具有笼形结构如图A(表面的小球是水分子,内部的大球是甲烷分子)。图A中最小的环中连接的原子总数是_______。可燃冰晶体具有多种笼状结构,其中一种由1个图A所示笼分别用2个面与另外两个相同的笼共面而成,则中间笼实际占有____个水分子。

(4)已知PH3分子的键角约为94%,而AsH3分子的键角约为91.8°,试用价层电子对互斥理论解释PH3的键角比AsH3的键角大的原因________________。
(5)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素有____。
(6)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示;试从结构的角度分析它们熔点不同的原因__________________。
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
(7)磷化铝晶胞如图所示,若两个铝原子之间的最近距离为dpm,NA代表阿伏加德罗常数的值,则磷化铝晶体的密度p=_____g/cm3。

【答案】 7 直线形 sp2 1、3 10 15 P原子半径比As原子半径小,PH3分子中成键电子对间的距离较近,斥力更大 Mg、Si、S 氮化硼、氮化铝、氮化镓都是原子晶体,键长依次增大,键能依次降低,熔点依次降低 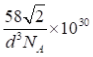
【解析】(1)考查原子运动状态的判断、以及空间构型,N原子核外有7个电子,即核外有7种不同运动状态的电子;如果以O为中心,有2个σ键,孤电子对数(6-2×3)/2=0,价层电子对数为2,因此N2O的空间构型为直线型;(2)考查杂化类型的判断和配位键形成,根据结构简式,C原子有3个σ键,无孤电子对,因此C的杂化类型为sp2;N最外层有5个电子,形成3个共价键达到稳定结构,2、4号N原子正好有3个共价键,因此无配位键,1、3号N原子有4个化学键,说明各有1个配位键,即能与钴离子通过配位键结合的氮原子的编号是1、3;(3)考查微粒个数的判断,表面的小球是水分子,水分子间通过分子间氢键连接到一起,图A中最小的环中连接的原子总数是10,可燃冰晶体具有多种笼状结构期中一种由1个图A所示笼分别用2个面与另外两个相同的笼共面而成,即中间笼有10个水分子不分摊,两个面与另外笼共面,名为正五边形,5个水分子,则实际占有10+5×2×1/2=15个水分子;(4)考查价层电子对互拆理论,PH3和AsH3,中心原子都有1个孤电子对,P原子半径比As原子半径小,PH3分子中成键电子对间的距离较近,斥力更大;(5)考查第一电离能的规律,同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此介于P和Al之间的元素是Mg、Si、S;(6)三种物质的结构类似于金刚石,因此氮化硼、氮化铝、氮化镓属于原子晶体,原子晶体熔沸点高低判断,利用半径大小进行,半径大小B<Al<Ga,因此键长依次增大,键能依次降低,熔点依次降低;(7)考查晶胞的计算,Al位于顶点和面心,实际占有Al的个数为8×1/8+6×1/2=4,P位于晶胞内部,个数为4,化学式为AlP,晶胞的质量为4×58/NAg,两个铝原子之间最近的距离是面对角线的一半,根据勾股定理,求出边长为![]() pm,在晶胞的体积为(
pm,在晶胞的体积为(![]() )3×10-30cm3,根据密度的定义,该晶胞的密度为
)3×10-30cm3,根据密度的定义,该晶胞的密度为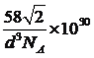 g/cm3。
g/cm3。

【题目】按如图装置进行实验,下列推断正确的是( )

选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
【题目】下列实验方案中,能达到相应实验目的的是( )
实验方案 |
|
|
|
|
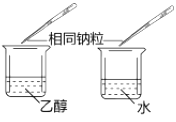
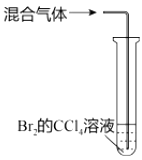
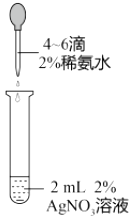
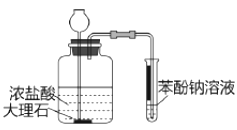
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A.A
B.B
C.C
D.D