题目内容
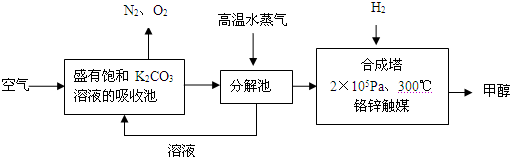
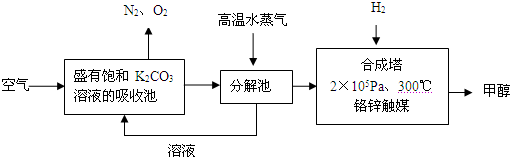
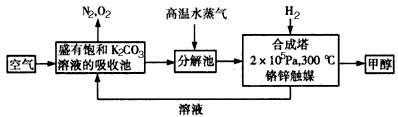
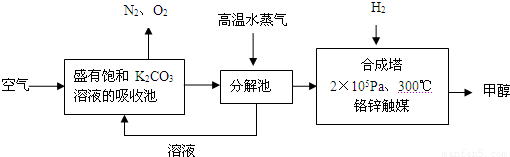
为减少和消除CO2对环境的影响,有科学家提出“绿色自由”的构想.既先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下: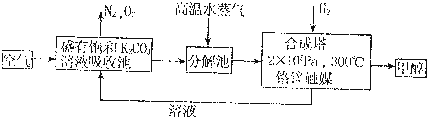
(1)写出分解池中反应方程式:
(2)在合成塔中,当有4.4kgCO2与足量H2完全反应,可放出热量4947kJ,写出合成塔中反应的热化学方程式:
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式:

(1)写出分解池中反应方程式:
2KHCO3
K2CO3+H2O+CO2↑
| ||
2KHCO3
K2CO3+H2O+CO2↑
| ||
(2)在合成塔中,当有4.4kgCO2与足量H2完全反应,可放出热量4947kJ,写出合成塔中反应的热化学方程式:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式:
CH3OH+8OH--6e-=CO32-+6H2O
CH3OH+8OH--6e-=CO32-+6H2O
.分析:(1)碳酸氢钾不稳定,加热时分解生成碳酸钾和二氧化碳、水.
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式.
(3)甲醇燃料电池中,负极上甲醇失去电子发生氧化反应,正极上氧气得电子发生还原反应.
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式.
(3)甲醇燃料电池中,负极上甲醇失去电子发生氧化反应,正极上氧气得电子发生还原反应.
解答:解:(1)二氧化碳和饱和的碳酸钾溶液反应生成碳酸氢钾,碳酸氢钾不稳定,加热时分解生成碳酸钾、二氧化碳和水,所以方程式为2KHCO3
K2CO3+H2O+CO2↑.
故答案为:2KHCO3
K2CO3+H2O+CO2↑.
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,所以1mol二氧化碳和足量氢气反应放出49.47KJ热量,所以其热化学反应方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol.
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol.
(3)甲醇燃料碱性电池中,甲醇在负极上发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
故答案为:CH3OH+8OH--6e-=CO32-+6H2O.
| ||
故答案为:2KHCO3
| ||
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,所以1mol二氧化碳和足量氢气反应放出49.47KJ热量,所以其热化学反应方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol.
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47KJ/mol.
(3)甲醇燃料碱性电池中,甲醇在负极上发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
故答案为:CH3OH+8OH--6e-=CO32-+6H2O.
点评:本题考查了电极反应式的书写、热化学反应方程式的书写等知识点,难度不大,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性,虽然燃料和氧化剂相同,如果电解质溶液不同,则电极反应式就不同.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目