题目内容
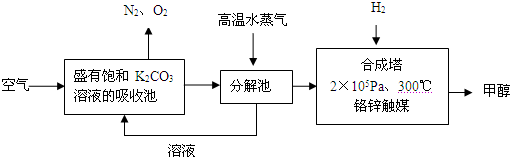
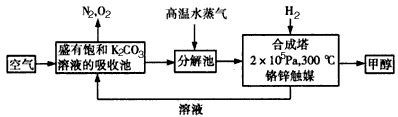
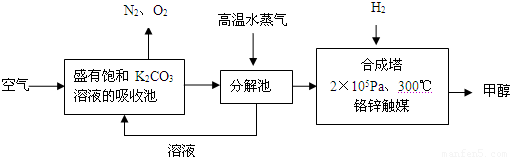
为减少和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.甲醇是一种可再生燃料,它的沸点为64.7℃.有科学家提出绿色构想:把含有CO2的空气或工业尾气通入碳酸钾溶液中,然后再把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想流程如下:(相对原子质量:C-12 O-16 Ca-40 Ba-137)
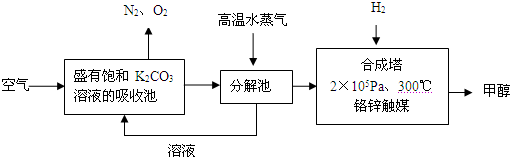
试回答下列问题:
(1)写出分解池中发生反应的化学方程式______.
(2)在2×105Pa、300℃合成塔中,若有CO2与H2反应生成32g甲醇和水,放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式:_____________.
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,合成塔中维持300℃的较高温度的原因可能是______;若要提高甲醇的产率,可采取的措施有(写2条):______、______.
(4)甲醇的一个重要作用是制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:______.
(5)常温常压下,饱和CO2水溶液的pH=5.6,c (H2CO3)=1.5×10-5mol?L-1,若忽略水的电离和H2CO3的二级电离,则H2CO3?HCO3-+H+的平衡常数K=______(计算结果保留2位有效数字,己知10-5.6=2.5×10-6).
(6)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积常数分别为4.96×10-9、2.58×10-9,该同学应该选用较合适的试剂是______(填字母).
A.Ba(OH)2溶液 B.Ca(OH)2溶液
C.BaCl2和NaOH混合溶液 D.CaCl2溶液.
解:(1)依据流程图分析判断,分解池中发生的反应为碳酸氢钾分解生成碳酸钾、二氧化碳和水,反应的化学方程式为:2KHCO3 K2CO3+CO2↑+H2O,
K2CO3+CO2↑+H2O,
故答案为:2KHCO3 K2CO3+CO2↑+H2O;
K2CO3+CO2↑+H2O;
(2)根据CO2与足量H2恰好完全反应生成32g甲醇和水,可放出49.5 kJ的热量,则生成1 mol CH3OH放出热量49.5 kJ的热量,所以热化学方程式为
CO2(g)+3H2(g)=CH3OH (g)+H2O(g)△H=-49.5kJ?mol-1,故答案为:CO2(g)+3H2(g)=CH3OH (g)+H2O(g)△H=-49.5kJ?mol-1;
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,较低温时反应速率过慢,生产效率低,合成塔中维持300℃的较高温度的原因提高反应速率,催化剂在此温度下活性最大,反应是放热反应,气体体积减小的反应,依据平衡移动原理可知反应正向进行提高甲醇的产率,
故答案为:该温度下催化剂的活性最高;降温;加压或将水和甲醇从混合体系中分离出来;
(4)燃料电池是燃料在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应;依据氧化还原反应电子守恒和电荷守恒,碱性电解质溶液中电极反应为:CH3OH+8OH--6e-=CO32-+6H2O或:2CH3OH+16OH--12e-=2CO32-+12H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O或:2CH3OH+16OH--12e-=2CO32-+12H2O;
(5)常温常压下,饱和CO2水溶液的pH=5.6,c(H+)=c(HCO3-)=10-5.6mol/L;c (H2CO3)=1.5×10-5mol?L-1,若忽略水的电离和H2CO3的二级电离,则H2CO3?HCO3-+H+的平衡常数K=
 =
=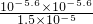 =
= =4.2×10-7mol?L-1,故答案为:4.2×10-7 mol?L-1;
=4.2×10-7mol?L-1,故答案为:4.2×10-7 mol?L-1;
(6)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全,故可选择Ba(OH)2(或NaOH溶液和BaCl2溶液)作为CO2的沉淀剂,测定的数据除空气的体积外,还需要测定实验时的温度、压强、沉淀的质量,故答案为:Ba(OH)2(或NaOH溶液和BaCl2溶液),故答案为:AD.
分析:(1)二氧化碳通入饱和碳酸钾溶液的吸收池中反应生成碳酸氢钾,高温水蒸气条件下分解生成碳酸钾、二氧化碳和水;
(2)依据热化学方程式书写方法,计算对应量下的反应热,书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位;写出热化学方程式;
(3)依据反应速率和催化剂的活性分析判断;根据平衡影响因素和平衡移动原理分析选择;
(4)燃料电池是燃料在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应;依据氧化还原反应电子守恒和电荷守恒,注意电解质溶液的环境因素写出电极反应;
(5)根据饱和溶液中PH计算氢离子浓度和碳酸氢根离子浓度,依据电解质电离平衡常数的概念计算;
(6)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全.
点评:本题以对CO2创新利用的研究为载体,考查热化学方程式、沉淀剂选择等知识,难度中等,旨在考查学生对知识的掌握及迁移运用能力.
 K2CO3+CO2↑+H2O,
K2CO3+CO2↑+H2O,故答案为:2KHCO3
 K2CO3+CO2↑+H2O;
K2CO3+CO2↑+H2O;(2)根据CO2与足量H2恰好完全反应生成32g甲醇和水,可放出49.5 kJ的热量,则生成1 mol CH3OH放出热量49.5 kJ的热量,所以热化学方程式为
CO2(g)+3H2(g)=CH3OH (g)+H2O(g)△H=-49.5kJ?mol-1,故答案为:CO2(g)+3H2(g)=CH3OH (g)+H2O(g)△H=-49.5kJ?mol-1;
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,较低温时反应速率过慢,生产效率低,合成塔中维持300℃的较高温度的原因提高反应速率,催化剂在此温度下活性最大,反应是放热反应,气体体积减小的反应,依据平衡移动原理可知反应正向进行提高甲醇的产率,
故答案为:该温度下催化剂的活性最高;降温;加压或将水和甲醇从混合体系中分离出来;
(4)燃料电池是燃料在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应;依据氧化还原反应电子守恒和电荷守恒,碱性电解质溶液中电极反应为:CH3OH+8OH--6e-=CO32-+6H2O或:2CH3OH+16OH--12e-=2CO32-+12H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O或:2CH3OH+16OH--12e-=2CO32-+12H2O;
(5)常温常压下,饱和CO2水溶液的pH=5.6,c(H+)=c(HCO3-)=10-5.6mol/L;c (H2CO3)=1.5×10-5mol?L-1,若忽略水的电离和H2CO3的二级电离,则H2CO3?HCO3-+H+的平衡常数K=
 =
=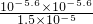 =
= =4.2×10-7mol?L-1,故答案为:4.2×10-7 mol?L-1;
=4.2×10-7mol?L-1,故答案为:4.2×10-7 mol?L-1;(6)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全,故可选择Ba(OH)2(或NaOH溶液和BaCl2溶液)作为CO2的沉淀剂,测定的数据除空气的体积外,还需要测定实验时的温度、压强、沉淀的质量,故答案为:Ba(OH)2(或NaOH溶液和BaCl2溶液),故答案为:AD.
分析:(1)二氧化碳通入饱和碳酸钾溶液的吸收池中反应生成碳酸氢钾,高温水蒸气条件下分解生成碳酸钾、二氧化碳和水;
(2)依据热化学方程式书写方法,计算对应量下的反应热,书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位;写出热化学方程式;
(3)依据反应速率和催化剂的活性分析判断;根据平衡影响因素和平衡移动原理分析选择;
(4)燃料电池是燃料在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应;依据氧化还原反应电子守恒和电荷守恒,注意电解质溶液的环境因素写出电极反应;
(5)根据饱和溶液中PH计算氢离子浓度和碳酸氢根离子浓度,依据电解质电离平衡常数的概念计算;
(6)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全.
点评:本题以对CO2创新利用的研究为载体,考查热化学方程式、沉淀剂选择等知识,难度中等,旨在考查学生对知识的掌握及迁移运用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目