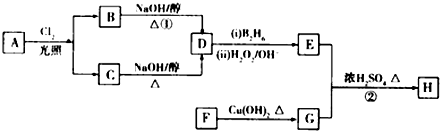
题目内容
【题目】下列说法正确的是( )
A.水的电离方程式:H2O=H++OH﹣
B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大
D.将稀醋酸加水稀释时,c(H+)减小,c(OH﹣)也减小
【答案】C
【解析】解:A、水为弱电解质,电离方程式为:H2OH++OH﹣ , 故A错误;B、溶液酸碱性只取决于溶液中氢离子浓度与氢氧根离子浓度的相对大小,氢离子浓度=氢氧根浓度,溶液一定呈中性,与pH值无必然关系,故B错误;
C、水的电离为吸热反应,升高温度,平衡右移,水的电离程度增大,故C正确;
D、水的离子积一定温度下为常数,醋酸稀释,氢离子浓度减小,氢氧根离子浓度增大,故D错误,
故选C.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
编号 | 实验操作 | 实验现象 |
① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增多。 |
② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液。 | 两支试管中均未明显见到有气泡产生。 |
(1)实验①的目的是其它条件相同时,探究______条件对H2O2分解速率的影响。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是____________________________________。
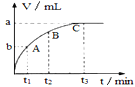
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是____(填字母代号)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
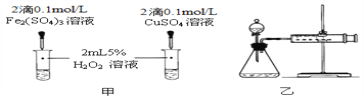
①定性分析:如图甲可通过观察________________________,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是______________________。
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是________________,所需仪器为_______。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________思想方法的应用。
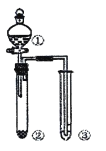
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 | 装置 |
A | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: N>C>Si |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡益均可以生成白色沉淀 | |
D | 浓硝酸 | 铝片 | 氢氧化钠溶液 | 浓硝酸具有强氧化性 |
A. A B. B C. C D. D