题目内容
【题目】NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2![]() 2NH3,测得平衡体系中NH3的物质的量分数如右图。
2NH3,测得平衡体系中NH3的物质的量分数如右图。

① 下列途径可提高氨气产率的是________(填字母)。
a. 采用常温条件 b. 采用高温条件
c. 将原料气加压 d. 将氨液化,不断移去液氨
② 右图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1________(填“>”“<”或“=”)K2。
(2)肼(N2H4)是一种火箭燃料。已知:
N2(g)+2O2(g)===2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534.0 kJ·mol-1
NO2(g)===1/2N2O4(g);ΔH=-28.0 kJ·mol-1
① 反应2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)的ΔH=________kJ·mol-1。
② 氨气与次氯酸钠溶液反应生成肼的离子方程式为__________________________。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如右图。

① 阴极的电极反应式为____________________________________。
② 将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果(已知:NH2Cl+H2O≒NH3+HClO),其原因是__________________________________________。
【答案】 cd = -1 079.7 2NH3+ClO-===Cl-+N2H4+H2O NO+5e-+6H+===NH![]() +H2O 1∶4 氯胺与水反应存在平衡:NH2Cl+H2O ≒ NH3+HClO,酸性条件下平衡右移使次氯酸浓度变大
+H2O 1∶4 氯胺与水反应存在平衡:NH2Cl+H2O ≒ NH3+HClO,酸性条件下平衡右移使次氯酸浓度变大
【解析】试题分析:(1)① 平衡正向移动可提高氨气产率;②物质的量分数为0.549和0.478时对应的温度都是400℃;(2)① 根据盖斯定律计算2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)的焓变;②根据氧化还原反应规律书写氨气与次氯酸钠溶液反应生成肼的离子方程式;(3)① 阴极得电子发生还原反应,所以阴极产物是NH![]() ;②电解总反应是8NO+7H2O=== 3NH4NO3+2HNO3,根据电解总反应分析通入氨气的物质的量; (4)酸性条件下NH2Cl+H2O ≒ NH3+HClO平衡正向移动。
;②电解总反应是8NO+7H2O=== 3NH4NO3+2HNO3,根据电解总反应分析通入氨气的物质的量; (4)酸性条件下NH2Cl+H2O ≒ NH3+HClO平衡正向移动。
解析:(1)①采用常温条件,反应速率慢,故a错误; b. 采用高温条件,平衡逆向移动,氨气的产率降低,故b错误; c. 将原料气加压,平衡正向移动,氨气的产率增大,故c正确; d. 将氨液化,不断移去液氨,平衡正向移动,氨气产率增大,故d正确;②物质的量分数为0.549和0.478时对应的温度都是400℃,温度相同,平衡常数相同,故K1=K2;
(2)①N2(g)+2O2(g)===2NO2(g);ΔH=+67.7 kJ·mol-1
②N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534.0 kJ·mol-1
③NO2(g)===1/2N2O4(g);ΔH=-28.0 kJ·mol-1
根据盖斯定律②×2-③×2-①得2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 079.7 kJ·mol-1;②根据氧化还原反应规律,氨气与次氯酸钠溶液反应生成肼和氯离子,离子方程式是2NH3+ClO-===Cl-+N2H4+H2O;(3)① 阴极得电子发生还原反应,所以阴极产物是NH![]() ,阴极反应式是NO+5e-+6H+===NH
,阴极反应式是NO+5e-+6H+===NH![]() +H2O;②电解总反应是8NO+7H2O=== 3NH4NO3+2HNO3,根据电解总反应将电解生成的HNO3全部转化为NH4NO3,则通入的NH3为2mol,所以通入的NH3与实际参加反应的NO的物质的量之比至少为2:8=1:4; (4)酸性条件下NH2Cl+H2O ≒ NH3+HClO平衡正向移动,使次氯酸浓度变大。
+H2O;②电解总反应是8NO+7H2O=== 3NH4NO3+2HNO3,根据电解总反应将电解生成的HNO3全部转化为NH4NO3,则通入的NH3为2mol,所以通入的NH3与实际参加反应的NO的物质的量之比至少为2:8=1:4; (4)酸性条件下NH2Cl+H2O ≒ NH3+HClO平衡正向移动,使次氯酸浓度变大。

【题目】某学生利用物质间的互变,设计成一个平面魔方,如图所示: 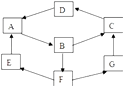
已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
依据以上信息填空:
(1)请写出E的电子式 .
(2)D的化学式 .
(3)请写出ABCDG所含的同种元素的原子结构示意图 .
(4)G生成C的过程中所出现的现象为
(5)写出A→B化学方程式:
(6)B→F的离子方程式为 .
