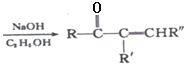
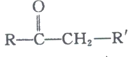题目内容
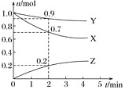
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下,830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B。
C(g)+D(g)反应的平衡常数和温度的关系如下,830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B。
温度 | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)反应达平衡后,升高温度,平衡_______移动(填“正向”或“逆向”)
(2)830℃达平衡时,A的转化率为________。
【答案】逆向 80%
【解析】
(1)根据平衡移动原理,结合温度与平衡常数的关系分析判断;
(2)假设A转化浓度为x,根据物质反应转化关系,可得平衡时各种物质的浓度,带入平衡常数表达式可得x的数值,然后利用转化率=![]() ×100%计算。
×100%计算。
(1)根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由表格数据可知,升高温度,该反应的化学平衡常数减小,说明升高温度平衡逆向移动,逆反应方向为吸热反应;
(2)在2 L的密闭容器中充入0.2 mol的A和0.8 mol的B,发生反应:A(g)+B(g)![]() C(g)+D(g),反应开始时c(A)=0.2 mol÷2 L=0.1 mol/L,c(B)=0.8 mol÷2 L=0.4 mol/L,c(C)=c(D)=0,假设反应达到平衡时A转化浓度为x,根据物质反应转化关系可知平衡时:c(C)=c(D)=x mol/L,c(A)=(0.1-x) mol/L,c(B)=(0.4-x) mol/L,由于在830℃时平衡常数为1.0,所以
C(g)+D(g),反应开始时c(A)=0.2 mol÷2 L=0.1 mol/L,c(B)=0.8 mol÷2 L=0.4 mol/L,c(C)=c(D)=0,假设反应达到平衡时A转化浓度为x,根据物质反应转化关系可知平衡时:c(C)=c(D)=x mol/L,c(A)=(0.1-x) mol/L,c(B)=(0.4-x) mol/L,由于在830℃时平衡常数为1.0,所以![]() =1.0,解得x=0.08 mol/L,所以830℃达平衡时,A的转化率=
=1.0,解得x=0.08 mol/L,所以830℃达平衡时,A的转化率=![]() ×100%=80%。
×100%=80%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
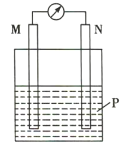
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D