��Ŀ����
��12�֣�A��B��C����ѧ��ѧ�г��������ֶ�����Ԫ�ء���֪����AԪ��ԭ�������������Ǵ�����������2������BԪ���������������۵Ĵ�����Ϊ2����CԪ���ж��ֻ��ϼۣ��ҳ�����CԪ�صĵ�����ʯ��ˮ��Ӧ���ɵõ����ֺ�CԪ�صĻ������B��C����Ԫ��������֮����AԪ����������4����
��1��д��������C�ĵ��ʺ�ʯ��ˮ��Ӧ�����ӷ���ʽ____________________ ��
����ǡ�÷�Ӧ������Һ�и�������Ũ���ɴ�С��˳���� ��
��2�������������ѧ��FuNvio Cacace���˻���˼��������о������B4��̬���ӡ�B4���ӽṹ������ӽṹ����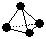 ����֪����1 mol B��B������167 kJ������������1 mol B��B���ų�942 kJ������д��B4ת��ΪB2���Ȼ�ѧ����ʽ�� ��
����֪����1 mol B��B������167 kJ������������1 mol B��B���ų�942 kJ������д��B4ת��ΪB2���Ȼ�ѧ����ʽ�� ��
�ɴ��ж���ͬ������B4��B2���ȶ���˳���ǣ�_____________ _�������Ͼ��û�ѧʽ��ʾ��
��3����B��C����Ԫ����ɵĻ�����X��������Ϊ�ӷ��ĵ���ɫҺ�壬X����Ϊ�����η��ӣ��ҷ�����B��C����ԭ���������ﵽ8�����ӵ��ȶ��ṹ��д��X�ĵ���ʽ�� ��
X��ˮ�������γ�һ�ֳ�����Ư�������ʡ���X��ˮ��Ӧ�Ļ�ѧ����ʽ��______________ _��
��1��д��������C�ĵ��ʺ�ʯ��ˮ��Ӧ�����ӷ���ʽ____________________ ��
����ǡ�÷�Ӧ������Һ�и�������Ũ���ɴ�С��˳���� ��
��2�������������ѧ��FuNvio Cacace���˻���˼��������о������B4��̬���ӡ�B4���ӽṹ������ӽṹ����
 ����֪����1 mol B��B������167 kJ������������1 mol B��B���ų�942 kJ������д��B4ת��ΪB2���Ȼ�ѧ����ʽ�� ��
����֪����1 mol B��B������167 kJ������������1 mol B��B���ų�942 kJ������д��B4ת��ΪB2���Ȼ�ѧ����ʽ�� ���ɴ��ж���ͬ������B4��B2���ȶ���˳���ǣ�_____________ _�������Ͼ��û�ѧʽ��ʾ��
��3����B��C����Ԫ����ɵĻ�����X��������Ϊ�ӷ��ĵ���ɫҺ�壬X����Ϊ�����η��ӣ��ҷ�����B��C����ԭ���������ﵽ8�����ӵ��ȶ��ṹ��д��X�ĵ���ʽ�� ��
X��ˮ�������γ�һ�ֳ�����Ư�������ʡ���X��ˮ��Ӧ�Ļ�ѧ����ʽ��______________ _��
����12�֣�
��1��C12��2OH��=ClO����H2O + Cl�� c(Ca2+)=c(Cl��)>c(ClO��)>c(OH��)>c(H+) ����2�֣�
��2��N4(g) =2N2(g) ��H=��882kJ��mol��1 N2>N4 ����2�֣�
��3��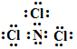 NCl3 + 3H2O ��NH3��+ 3HClO ����2�֣�
NCl3 + 3H2O ��NH3��+ 3HClO ����2�֣�
��1��C12��2OH��=ClO����H2O + Cl�� c(Ca2+)=c(Cl��)>c(ClO��)>c(OH��)>c(H+) ����2�֣�
��2��N4(g) =2N2(g) ��H=��882kJ��mol��1 N2>N4 ����2�֣�
��3��
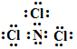 NCl3 + 3H2O ��NH3��+ 3HClO ����2�֣�
NCl3 + 3H2O ��NH3��+ 3HClO ����2�֣�������������ݶ�����Ԫ�أ�AԪ��ԭ�������������Ǵ�����������2������AΪ̼Ԫ�أ�BԪ���������������۵Ĵ�����Ϊ2����BΪ������Ԫ�أ����ɢ�C����Ϊ��Ԫ�أ��ɢ�AԪ����������4��Ϊ6��4=24��B��������Ϊ24-17=7����BΪ��Ԫ�أ��������Ԫ���γɵ����ʵ����ʼ��ṹ����ɡ�
�ɶ�����Ԫ�أ�AԪ��ԭ�������������Ǵ�����������2������AΪ̼Ԫ�أ�BԪ���������������۵Ĵ�����Ϊ2����BΪ������Ԫ�أ����ɢ�C����Ϊ��Ԫ�أ��ɢ�AԪ����������4��Ϊ6��4=24��B��������Ϊ24-17=7����BΪ��Ԫ�ء�
��1����CΪ��Ԫ�أ�������ʯ��ˮ��Ӧ���������Ӻʹ���������Ӻ�ˮ�����ӷ���ʽΪC12+2OH-=ClO-+Cl-+H2O���ʴ�Ϊ��C12+2OH-=ClO-+Cl-+H2O��
��2����BΪ��Ԫ�أ�����1molB-B����167kJ������������1molB��B�ų�942kJ��������N4��g���T2N2��g���ġ�H="167��6-2��942=-882" kJ/mol��
�ʴ�Ϊ��N4��g���T2N2��g����H=-882kJ/mol��
��3��BΪ��Ԫ�ء�CΪ��Ԫ�أ�X����Ϊ�����η��ӣ��ҷ�����B��C����ԭ���������ﵽ8�����ӵ��ȶ��ṹ��������Ԫ����ɵĻ�����XΪNCl3���ṹ�д�������
N-Cl���۵�������ṹʽΪ
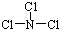 ����X��ˮ�������γ�һ�ֳ�����Ư�������ʼ�Ԫ���غ��֪��ӦΪNCl3+3H2O�TNH3+3HClO��
����X��ˮ�������γ�һ�ֳ�����Ư�������ʼ�Ԫ���غ��֪��ӦΪNCl3+3H2O�TNH3+3HClO���ʴ�Ϊ��
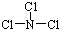 ��NCl3+3H2O�TNH3+3HClO��
��NCl3+3H2O�TNH3+3HClO�� ������������Ԫ�ص�λ�á��ṹ������Ϊ��Ϣ������Ԫ�ص��ƶϣ�Ȼ������Ԫ����ɵ����ʵ������������ȷ���ʵ����ʡ���Ӧ�ȵļ��㡢�������������ʵĹ�ϵ�ȼ��ɽ���ۺ���ǿ�����ϸ߿������ⷽ��

��ϰ��ϵ�д�
�����Ŀ
 ����E�ķ�Ӧ���������з�Ӧ��ͼ��գ�
����E�ķ�Ӧ���������з�Ӧ��ͼ��գ�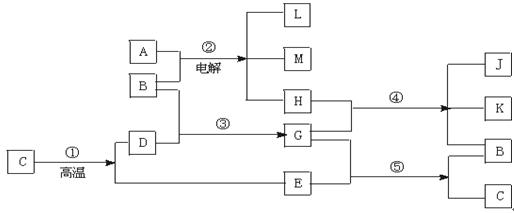
 ����
����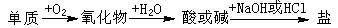
 ��A������ͬԪ�صĻ��������֮��������ת����ϵ��
��A������ͬԪ�صĻ��������֮��������ת����ϵ��
 ______________
______________