题目内容
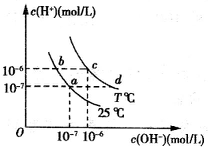 在不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示.下列有关说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示.下列有关说法中正确的是( )| A、若从a点到c点,可采用在水中加入酸的方法 | B、b点对应的醋酸中由水电离的c(H+)=10-6mol/L | C、c点对应溶液的Kw大于d点对应溶液的Kw | D、T℃时,0.05 mol?L-1的Ba(OH)2溶液的pH=11 |
分析:水的离子积为Kw=c(H+)×c(OH-),由图可知,a、b均在25℃,离子积相同;而c、d均在T℃,离子积相同,离子积常数只与温度有关,与溶液的酸碱性无关,根据离子积常数进行有关计算.
解答:解:A.离子积常数只与温度有关,与溶液的酸碱性无关,a、c两点的离子积常数不同,说明c和c点的温度不同,所以在水中加入酸不能使a点到c点,故A错误;
B.b点对应的醋酸中c(H+)=10-6mol/L,则由水电离的c(H+)=10-8mol/L,故B错误;
C.c、d均在T℃,离子积相同,故C错误;
D.T℃时,0.05 mol?L-1的Ba(OH)2溶液中c(OH-)=0.05 mol?L-1×2=0.1mol/L,则
mol/L=10-11mol/L,溶液的pH=11,故D正确;
故选D.
B.b点对应的醋酸中c(H+)=10-6mol/L,则由水电离的c(H+)=10-8mol/L,故B错误;
C.c、d均在T℃,离子积相同,故C错误;
D.T℃时,0.05 mol?L-1的Ba(OH)2溶液中c(OH-)=0.05 mol?L-1×2=0.1mol/L,则
| 10-6×10-6 |
| 0.1 |
故选D.
点评:本题考查离子积常数的有关知识,题目难度中等,注意分析图象,把握水的离子积只受温度的影响.

练习册系列答案
相关题目
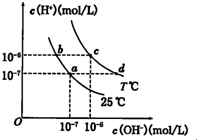 在不同温度下.水溶液中c(H+)与c(OH+)有如图所示的关系,下列说法中不正确的是( )
在不同温度下.水溶液中c(H+)与c(OH+)有如图所示的关系,下列说法中不正确的是( )| A、图中T>25 | B、b点溶液c(H+)一定比a点大 | C、c点对应的洛液中可能大量存在Al3+、Cl- | D、d点对应的溶液呈碱性 |
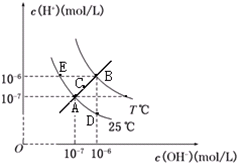 在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法不正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示.下列说法不正确的是( )| A、图中五点Kw间的关系:B>C>A=D=E | B、E点对应的水溶液中,可能有NH4+、Ba2+、Cl-、I-大量同时存在 | C、若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合,所得溶液呈中性 | D、若0.1 mol/L的NaHA溶液水溶液中c(H+)与c(OH-)关系如图D点所示,则溶液中有:c(HA-)>c(OH-)>c(A2-)>c(H2A) |
 在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是( )
在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是( ) 在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示.请回答下列问题:
在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示.请回答下列问题: