题目内容
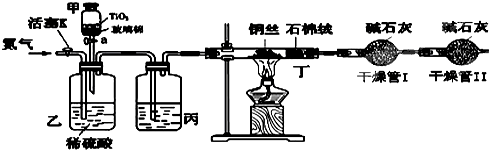
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液.回答下列问题:
(1)发生氧化反应的烧杯是________(填“甲”或“乙”).
(2)外电路的电流方向为:从________到________.(填“a”或“b”)
(3)电池工作时,盐桥中的SO移向________(填“甲”或“乙”)烧杯.
(4)甲烧杯中发生的电极反应为______________________________________________.
(1)乙 (2)a b (3)乙
(4)MnO4—+8H++5e-===Mn2++4H2O
解析:

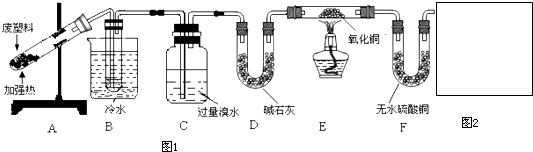
废旧塑料回收和利用是减轻“白色污染”、实现资源再利用的有效途径之一。某兴趣小组进行如下探究:
【实验课题】废旧聚丙烯塑料热分解主要产物的探究
【查阅资料】①石蜡热分解的产物为常温下的气态烃和液态烃
②CuO能将烃氧化成CO2和H2O
③苯甲酸能溶于苯
【实验设计】
| |
【实验记录】
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E装置中黑色氧化铜变红;④F装置中无水硫酸铜变蓝。
【问题讨论】请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物。若要除去其中的甲苯,实验操作方法是 ;
(2)C装置的作用是 ;
(3)如果不设置D装置,对实验结论产生的影响是 ;
(4)甲同学认为从C中出来的气体是氢气,乙同学认为还可能有其它成分。你认为其他成分可能是
。为完善实验设计,请在上图方框内画出装置图并注明其中盛放的试剂名称。