题目内容
18.(1)把20g NaOH溶解在90g水中,才能使得每10个水分子中有1个Na+,这时所得溶液的质量分数是0.182.(2)中和含0.2mol HCl的稀盐酸,需NaOH物质的量为0.2mol,如改用KOH,则所需KOH的质量为11.2.
分析 (1)利用个数之比等于物质的量之比及n=$\frac{m}{M}$、w%=$\frac{m(溶质)}{m(溶液)}$×100%来计算;
(2)根据反应H++OH-═H2O计算需要NaOH、KOH的物质的量,根据m=nM计算KOH的质量.
解答 解:(1)设NaOH的质量为x,由每10个水分子中含有1个Na+,则$\frac{\frac{xg}{40g/mol}}{\frac{90g}{18g/mol}}$=$\frac{1}{10}$,解得x=20g,
则所得溶液中NaOH的质量分数为$\frac{20g}{20g+90g}$×100%=18.2%,
故答案为:20;18.2%;
(2)由反应H++OH-═H2O可知,n(NaOH)=n(HCl)=0.2mol,n(KOH)=n(HCl)=0.2mol,m(KOH)=0.2mol×56g/mol=11.2g,
故答案为:0.2mol;11.2g.
点评 本题考查物质的量的计算及阿伏伽德罗定律的应用、质量守恒定律的应用,明确计算公式及定律的意义即可解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④0.1NA硫酸分子与8.8g CO2含有相同的氧原子数
⑤0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,22.4L水所含分子数为NA
⑦17g氨气所含电子数目为10NA.
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④0.1NA硫酸分子与8.8g CO2含有相同的氧原子数
⑤0.5mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,22.4L水所含分子数为NA
⑦17g氨气所含电子数目为10NA.
| A. | ①②⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ⑤⑦ | D. | ④⑤⑦ |
9.硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g)△H=-9072kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1 K=4,.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.02kJ•mol-1 K=7,.1×1034
其中,②、③是副反应.若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g)△H=-9072kJ•mol-1 K=1.1×1026
②4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1 K=4,.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.02kJ•mol-1 K=7,.1×1034
其中,②、③是副反应.若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
| A. | 增大O2浓度 | B. | 使用合适的催化剂 | ||
| C. | 减小压强 | D. | 降低温度 |
6.关于电解精炼铜的说法正确的是( )
| A. | 粗铜作阴极? | |
| B. | 用CuSO4作电解质溶液 | |
| C. | 阳极只发生Cu-2e-═Cu2+反应,其它杂质沉淀为阳极泥 | |
| D. | 电解质溶液的组成和浓度都不改变? |
10.分类是学习和研究中一种常用的方法,下列物质分类不正确的是( )
| A. | 生理盐水---混合物 | B. | 金刚石---单质 | ||
| C. | 冰-化合物 | D. | 纯碱-碱 |
 ,结构简式H2C=CH2.
,结构简式H2C=CH2. ,反应类型是加聚反应.
,反应类型是加聚反应. )与乙醇(
)与乙醇( )反应生成酯(
)反应生成酯( )和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键.试完成下列反应方程式:
)和水的反应机理,反应过程中酸分子断裂C-O单键,醇分子断裂O-H键.试完成下列反应方程式: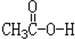 +CH3CH2-18O-H$\stackrel{一定条件}{→}$CH3CO18OCH2CH3+H2O.
+CH3CH2-18O-H$\stackrel{一定条件}{→}$CH3CO18OCH2CH3+H2O.