题目内容
【题目】微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示: 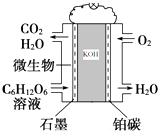
(1)电池工作时,石墨电极上发生(填“氧化”或“还原”)反应,
(2)阳离子移向(填“石 墨”或“铂碳”)电极,
(3)该电池负极电极上反应的电极反应式为 .
(4)当有8mol电子发生转移时消耗的氧气在标况下为L.
【答案】
(1)氧化
(2)铂碳
(3)C6H12O6+36OH﹣﹣24e﹣═6CO32﹣+24H2O
(4)44.8
【解析】解:(1)燃料电池的正极上是氧气发生得电子的还原反应,故石墨为负极,发生氧化反应,所以答案是:氧化;(2)阳离子向正极移动,铂碳为正极,故移向铂碳电极,所以答案是:铂碳;(3)石墨为负极,电极反应式为C6H12O6+36OH﹣﹣24e﹣═6CO32﹣+24H2O,所以答案是:C6H12O6+36OH﹣﹣24e﹣═6CO32﹣+24H2O;(4)正极反应O2+4H++4e﹣=2H2O,当4mol电子转移时消耗1mol氧气,8mol电子转移消耗2mol氧气,标况下体积为2×22.4=44.8L,所以答案是:44.8.

【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用催化剂为(填序号) . a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)用电子式表示①、④两种元素形成18电子的形成过程 .
【题目】根据题意填空
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是 .
A.SO32﹣和NO2﹣
B.NO3﹣和SO3
C.H3O+和ClO3﹣
D.PO43﹣和SO32﹣
(2)CaF2的晶胞如图所示. 
①下列有关CaF2的表达正确的是
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示,已知[AlF6]3﹣在溶液中可稳定存在).
③晶胞中F﹣的配位数是 , 与一个Ca2+等距离且最近的Ca2+有个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能/kJmol﹣1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |
④写出Cu原子核外电子排布式;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 .