题目内容
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体。某研究小组用下图所示的实验装置,利用浓氨水、干冰等作原料制备氨基甲酸铵。
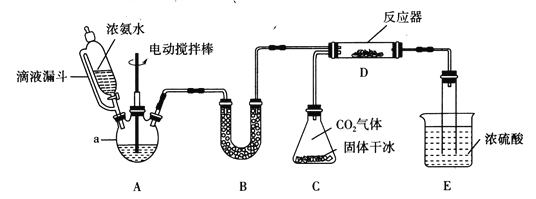
(1)仪器a的名称是____________;与分液漏斗相比,使用滴液漏斗的优点是:______________________________________。
(2)装置B中盛装药品的名称是________________。
(3)写出装置D中发生反应的化学方程式:__________________________________。
(4)装置E的作用之一是控制原料气按反应计量系数充分反应。若反应初期观察到装置内浓硫酸中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速;装置E的作用还有___________________________________________________。
(5)已知氨基甲酸铵可完全水解为碳酸氢铵。为测定氨基甲酸铵样品的纯度,取样品1.600g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000g。
①写出碳酸氢铵与足量石灰水反应的离子方程式:______________________________。
②样品中氨基甲酸铵的质量分数为_____________%。
【答案】 三颈烧瓶 使滴液漏斗与三颈烧瓶内压强相等,便于液体顺利流下 碱石灰(或氧化钙或氢氧化钠固体) CO2+2NH3=H2NCOONH4 加快 防止氨气逸出,污染空气,同时防止倒吸,防止空气中的水蒸气进入反应器 NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3·H2O+H2O 97.5
【解析】(1)根据仪器a的构造特点可判断名称是三颈烧瓶;与分液漏斗相比,使用滴液漏斗的优点是使滴液漏斗与三颈烧瓶内压强相等,便于液体顺利流下。(2)生成的氨气中含有水蒸气,反应前需要干燥,因此装置B中盛装药品的名称是碱石灰(或氧化钙或氢氧化钠固体)。(3)根据装置图可知反应物是氨气和CO2,生成物是氨基甲酸铵(H2NCOONH4),则根据原子守恒可知装置D中发生反应的化学方程式为CO2+2NH3=H2NCOONH4。(4)若反应初期观察到装置内浓硫酸中产生气泡,这说明CO2的产生速率过快,有剩余,因此应该加快产生氨气的流速;氨气会污染大气,又因为氨基甲酸铵易水解,所以装置E的作用还有防止氨气逸出,污染空气,同时防止倒吸,防止空气中的水蒸气进入反应器。(5)①碳酸氢铵与足量石灰水反应的离子方程式为NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3·H2O+H2O。②碳酸钙的物质的量是2g÷100g/mol=0.02mol,根据碳原子守恒可知氨基甲酸铵的物质的量是0.02mol,质量是0.02mol×78g/mol=1.56g,则样品中氨基甲酸铵的质量分数为1.56g/1.60g×100%=97.5%。

【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2SO3 | Na2SiO3溶 | 非金属性:S>Si | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D



