题目内容
【题目】青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________I1(Ne)填"〉”或“<")。
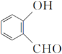
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____,硫酸的结构式为_____。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________,影响△H2递变的因素为________。

【答案】B > σ键、π键  氟化氢与水分子间存在分子间氢键 键能
氟化氢与水分子间存在分子间氢键 键能
【解析】
(1)依据元素周期表的对角线原则,与Si的化学性质相似的邻族元素是B;
(2)根据Na的正电性较强,对核外电子的吸引力比氖强,想失去电子需要更多的能量,因此Na的第二电离能比氖的第一电离能高;
(3)HClO4为分子晶体,H和O之间Cl和O之间含有σ键,HClO4分子中存在的非羟基氧与Cl以双键形式结合,即HClO4中存在π键;硫酸化学式为H2SO4,硫酸为二元强酸,有两个羟基,即硫酸的结构式为 ;
;
(4)由于氟化氢与水分子间存在分子间氢键,溶液状态转化成气态时所吸收的能量高,△H1(HF)特别大;△H2表示卤化氢分解成原子,是破坏共价键的过程,因此影响△H2递变的直接原因是H-X键的键能。

【题目】下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )

选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | 石蕊溶液 |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | 石蕊溶液 |
A.AB.BC.CD.D
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、 Cu2 (OH)2 CO3等杂质]为原料制取二氧化锰.其工艺流程示意图如下图所示:

已知生成氢氧化物沉淀的pH如下表所示:
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度均为0.1mol·L—1
请回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是__________;盐酸溶解MnCO3的化学方程式是____________________________。
(2)向溶液1中加入双氧水时.发生反应的离子方程式是_________________。
(3)向滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,发生反应的离子方程式是_________________________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,请完成该反应的离子方程式:5Mn2++2ClO3—+____===____+_____+_____。
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是______________________。
②若在上述MnO2溶液中加入一定量的Mn(NO3 )2粉末.则无Cl2产生.其原因是______。