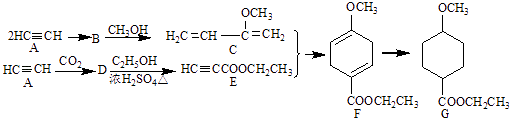题目内容
【题目】某实验小组对含有Al3+的未知溶液进行了如下分析:
(1)滴加少量NaOH溶液,无明显变化;
(2)继续滴加NaOH溶液,有白色胶状沉淀生成;
(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。
实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是 ( )
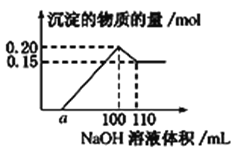
A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=40
D. 若将最终沉淀过滤、洗涤、灼烧,其质量可能为6 g
【答案】C
【解析】A. 据图可知,加入NaOH溶液,开始时无沉淀产生,说明溶液中有较多H+,继续滴入氢氧化钠溶液生成白色沉淀,说明一定生成氢氧化铝沉淀,溶液中含有Al3+,加入过量的氢氧化钠溶液沉淀减少但未完全消失,说明溶液中除了铝离子,应还有另一种金属阳离子,该未知溶液中至少含有3种阳离子,故A正确;B. 溶解氢氧化铝消耗的氢氧化钠溶液是10mL,而氢氧化铝的物质的量是(0.20-0.15)mol=0.05mol,则根据反应Al(OH)3+OH=AlO2+2H2O可知,氢氧化钠溶液的物质的量浓度是c(NaOH)=0.05mol÷0.01L=5mol/L,故B正确;C. 若另一种离子为二价阳离子,设该离子为M2+,据图可知,M(OH)2沉淀的物质的量是0.15mol,由M2++2OH=M(OH)2↓可知,生成M(OH)2沉淀时消耗氢氧化钠溶液的体积是V(NaOH)=0.15mol×2÷5mol/L=60mL,氢氧化铝的物质的量是0.05mol,根据Al3++3OH=Al(OH)3↓可知,生成氢氧化铝时消耗氢氧化钠溶液的体积是30mL,所以a=10,故C错误;D. 若另一种二价阳离子为Mg2+,则加入过量NaOH溶液后最终所得沉淀为Mg(OH)2,将沉淀过滤、洗涤、灼烧,所得物质为MgO,其物质的量为0.15mol,质量为6 g,故D正确;答案选C。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案