题目内容
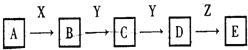
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示:
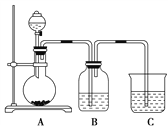
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,C装置中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为____________,C中可观察到的现象是________。
(2)B装置的作用是______________。
(3)根据实验现象推知,碳酸、硝酸、原硅酸的酸性强弱顺序是________,由此得出碳、氮、硅三种元素非金属性的强弱顺序是________________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯元素和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:__________________________。
(5)C装置的作用是_______________________。
(6)实验结论:氧化性:________,非金属性:________。
【答案】 CaCO3+2H+===Ca2++CO2↑+H2O 溶液变浑浊 除去二氧化碳中混有的硝酸蒸气 HNO3>H2CO3>H4SiO4 N>C>Si Cl2+2Br-===Br2+2Cl- 吸收尾气,防止氯气污染环境 Cl2>Br2 Cl>Br
【解析】本题分析:本题主要考查对于探究实验“元素性质的递变规律”的评价。
(1)A中发生大理石与稀硝酸的反应,反应的离子方程式为CaCO3+2H+===Ca2++CO2↑+H2O,C中Na2SiO3转化为H2SiO3,可观察到的现象是溶液变浑浊。
(2)硝酸具有挥发性,为了防止硝酸的干扰,需要除去硝酸, B装置的作用是除去二氧化碳中混有的硝酸蒸气。
(3) 最高价氧化物水化物的酸性越强,非金属性越强。碳酸、硝酸、原硅酸的酸性强弱顺序是HNO3>H2CO3>H4SiO4,由此得出碳、氮、硅三种元素非金属性的强弱顺序是N>C>Si。
(4)A装置产生氯气,B装置发生氯气与溴化合物之间的置换反应,B装置中发生反应的离子方程式:Cl2+2Br-===Br2+2Cl-。
(5)氯气有毒,C装置的作用是吸收尾气,防止氯气污染环境。
(6)氯气置换溴,实验结论:氧化性:Cl2>Br2,非金属性:Cl>Br。

【题目】下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
A. A B. B C. C D. D