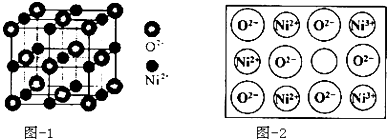
题目内容
【题目】已知A~H 均为短周期元素、请回答下列问题:
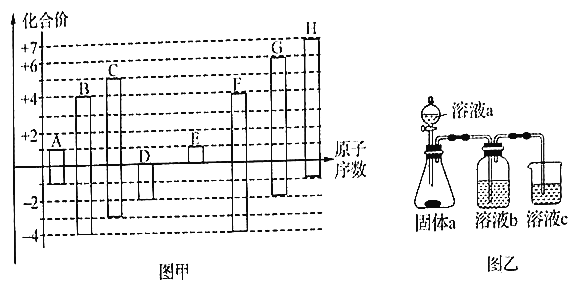
(1)F元素在周期表中的位置为________,A 和D形成的既有极性键又有非极性键的化合物,其电子式为________ 。
(2)D、E、G、H 的简单离子半径由大到小的顺序为(写化学式) ________ 。
(3)用电子式表示出E、H 两种元素组成的化合物的形成过程________ 。
(4)用乙图装置证明酸性:HCl>H2CO3>H2SiO3,则溶液b为________;溶液c中的离子方程式为________。下列事实可用于比较元素碳与Cl 非金属性相对强弱的是________。
a.最高正化合价Cl>C
b.C1的氢化物比C 的简单氢化物稳定
C.C1的氢化物比C 的简单氢化物沸点高
d.最高价氧化物的水化物的酸性:HC1O4>H2CO3
(5)A和D形成为18电子分子与A和G形成的13电了分子按4 :1的个数比反应的离子方程式为________。
【答案】 第三周期IVA族 ![]() S2->Cl->O2->Na+
S2->Cl->O2->Na+ ![]() 饱和碳酸氢钠溶液 H2O+CO2+SiO32-=H2SiO3↓+CO32- 或2H2O+2CO2+SiO32-=H2SiO3↓+2HCO3- bd 4H2O2+H2S=SO42-+2H++4H2O
饱和碳酸氢钠溶液 H2O+CO2+SiO32-=H2SiO3↓+CO32- 或2H2O+2CO2+SiO32-=H2SiO3↓+2HCO3- bd 4H2O2+H2S=SO42-+2H++4H2O
【解析】已知A~H均为短周期元素,H有+7和-1价,原子序数最大,则H是Cl。同样分析可知G是S,F是Si,E是Na,D是O,C是N,B是C,A是H。
(1)Si元素在周期表中的位置为第三周期IVA族,A和D形成的既有极性键又有非极性键的化合物是双氧水,其电子式为![]() 。(2)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则D、E、G、H的简单离子半径由大到小的顺序为(写化学式)S2->Cl->O2->Na+。(3)E、H两种元素组成的化合物是离子化合物氯化钠,形成过程为
。(2)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则D、E、G、H的简单离子半径由大到小的顺序为(写化学式)S2->Cl->O2->Na+。(3)E、H两种元素组成的化合物是离子化合物氯化钠,形成过程为![]() 。(4)用乙图装置证明酸性HCl>H2CO3>H2SiO3,由于生成的二氧化碳中含有挥发出的氯化氢,则溶液b为饱和碳酸氢钠溶液,用来除去氯化氢;溶液c中的离子方程式为H2O+CO2+SiO32-=H2SiO3↓+CO32-或2H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-。a.非金属性强弱与元素的最高价没有关系,a错误;b.C1的氢化物比C的简单氢化物稳定说明氯元素非金属性强于碳元素,b正确;C.C1的氢化物比C的简单氢化物沸点高与非金属性强弱无关,c错误;d.最高价氧化物的水化物的酸性HC1O4>H2CO3说明氯元素非金属性强于碳元素,d正确;答案选bd;(5)A和D形成为18电子分子是双氧水,与A和G形成的18电了分子是H2S,二者按4:1的个数比反应的离子方程式为4H2O2+H2S=SO42-+2H++4H2O。
。(4)用乙图装置证明酸性HCl>H2CO3>H2SiO3,由于生成的二氧化碳中含有挥发出的氯化氢,则溶液b为饱和碳酸氢钠溶液,用来除去氯化氢;溶液c中的离子方程式为H2O+CO2+SiO32-=H2SiO3↓+CO32-或2H2O+2CO2+SiO32-=H2SiO3↓+2HCO3-。a.非金属性强弱与元素的最高价没有关系,a错误;b.C1的氢化物比C的简单氢化物稳定说明氯元素非金属性强于碳元素,b正确;C.C1的氢化物比C的简单氢化物沸点高与非金属性强弱无关,c错误;d.最高价氧化物的水化物的酸性HC1O4>H2CO3说明氯元素非金属性强于碳元素,d正确;答案选bd;(5)A和D形成为18电子分子是双氧水,与A和G形成的18电了分子是H2S,二者按4:1的个数比反应的离子方程式为4H2O2+H2S=SO42-+2H++4H2O。

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ![]()
![]() +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前20 min的平均速率为v(H2)=0.004molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08molL﹣1 , 则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 达到平衡前v(正)>v(逆)