题目内容
把4mol N2和8mol H2置于5L密闭容器合成氨反应,经过2min后达到平衡时测得混合气体中含NH3的体积百分比为20%,求:(1)混合气体中含H2的体积百分比;
(2)反应前后容器内的压强比;
(3)N2和H2的转化率.(4)求H2的反应速率.
【答案】分析:根据反应方程式,利用三段式解题法,列方程,求出2min后达到平衡,体系各组分的物质的量;再逐题解答.
(1)根据体积百分比定义计算;
(2)一定条件下,压强之比大于物质的量之比;
(3)根据转化率的定义计算;
(4)根据v=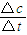 计算.
计算.
解答:解:设参加反应N2 的物质的量为xmol,
则:N2 (气)+3H2 (气)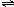 2NH3(气)
2NH3(气)
开始 4mol 8mol 0mol
变化 xmol 3xmol 2xmol
平衡 (4-x)mol (8-3x)mol 2xmol
所以有: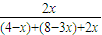 =20%,解得x=1
=20%,解得x=1
(1)、混合气体中含H2的体积百分比为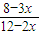 ×100%=
×100%=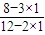 ×100%=50%;
×100%=50%;
答:混合气体中含H2的体积百分比为50%
(2)平衡时,反应混合物的总物质的量为(12-2x)=(12-2×1)mol=10mol,
反应前后容器内的压强比为(4+8)mol:10mol=6:5;
答:反应前后容器内的压强比为6:5
(3)N2的转化率为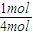 ×100%=25%,
×100%=25%,
H2的转化率为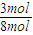 ×100%=37.5%;
×100%=37.5%;
答:N2的转化率为25%,H2的转化率为37.5%.
点评:本题考查了化学平衡的有关计算,难度不大,三段式法是解答化学平衡计算的常用方法,注意总结归纳.
(1)根据体积百分比定义计算;
(2)一定条件下,压强之比大于物质的量之比;
(3)根据转化率的定义计算;
(4)根据v=
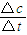 计算.
计算.解答:解:设参加反应N2 的物质的量为xmol,
则:N2 (气)+3H2 (气)
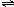 2NH3(气)
2NH3(气)开始 4mol 8mol 0mol
变化 xmol 3xmol 2xmol
平衡 (4-x)mol (8-3x)mol 2xmol
所以有:
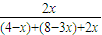 =20%,解得x=1
=20%,解得x=1(1)、混合气体中含H2的体积百分比为
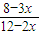 ×100%=
×100%=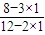 ×100%=50%;
×100%=50%;答:混合气体中含H2的体积百分比为50%
(2)平衡时,反应混合物的总物质的量为(12-2x)=(12-2×1)mol=10mol,
反应前后容器内的压强比为(4+8)mol:10mol=6:5;
答:反应前后容器内的压强比为6:5
(3)N2的转化率为
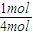 ×100%=25%,
×100%=25%,H2的转化率为
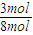 ×100%=37.5%;
×100%=37.5%;答:N2的转化率为25%,H2的转化率为37.5%.
点评:本题考查了化学平衡的有关计算,难度不大,三段式法是解答化学平衡计算的常用方法,注意总结归纳.

练习册系列答案
相关题目