题目内容
13.下列反应的离子方程式书写正确的是( )| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 钠与硫酸氢钾溶液反应:2Na+2H+═2Na++H2↑ | |
| C. | 过氧化钠与水反应:2O${\;}_{2}^{2-}$+2H2O═4OH-+O2↑ | |
| D. | 铝粉与NaOH溶液反应:2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+H2↑ |
分析 A.电子、电荷不守恒;
B.反应实质为Na与氢离子反应;
C.过氧化钠在离子反应中保留化学式;
D.电子不守恒.
解答 解:A.钠与水反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.钠与硫酸氢钾溶液反应的离子反应为2Na+2H+═2Na++H2↑,故B正确;
C.过氧化钠与水反应的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故C错误;
D.铝粉与NaOH溶液反应的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒分析,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
3.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol Fe与足量稀盐酸反应时,转移电子的数目为3 NA | |
| B. | 标准状况下,22.4 L水中含有水分子的数目为NA | |
| C. | 14 g N2中含有电子的数目为7 NA | |
| D. | 数目为NA的一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
4.下列对宏观现象的微观解释不正确的是( )
| A. | 好酒不怕巷子深----分子在不断的运动 | |
| B. | 热胀冷缩----温度升高,分子变大 | |
| C. | 给轮胎打气----分子之间有间隔 | |
| D. | 湿衣服在夏天比在冬天干得快----温度升高,分子运动速率加快 |
1.下列操作或判断错误的是( )
| A. | 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,从分液漏斗下端放出I2的CCl4溶液 | |
| B. | 某元素由化合态转化为游离态,该元素一定被氧化 | |
| C. | 除去CO气体中少量的CO2:通过盛有NaOH溶液的洗气瓶 | |
| D. | 某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中含有SO42- |
8.下列叙述正确的是( )
| A. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同位素,性质相似 | |
| B. | 铁放入稀硫酸中,再加入硝酸钠可以加快放出氢气的速率 | |
| C. | 明矾和漂白粉常用于自来水净化和杀菌消毒,两者作用原理相同 | |
| D. | C(石墨,s)=C(金刚石,s)△H>0,所以石墨比金刚石稳定 |
18.下列反应的离子方程式中,正确的是( )
| A. | 稀硫酸与氢氧化钡反应:Ba2++SO42-═BaSO4↓ | |
| B. | 铁和稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化铜溶于稀硫酸:Cu(OH)2+2H+═2H2O+Cu2+ | |
| D. | 盐酸与石灰石溶液反应:CO32-+2H+═H2O+CO2↑ |
5.把氯气通入紫色石蕊试液中,出现的现象是( )
| A. | 试液最终变为红色 | B. | 试液不变色 | ||
| C. | 试液直接褪为无色 | D. | 试液先变红,后褪色 |
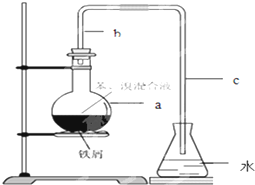 化学课外小组用如图装置制取溴苯.
化学课外小组用如图装置制取溴苯. .
.