题目内容
用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为( )A.0.1mol/L
B.1mol/L
C.2mol/L
D.4mol/L
【答案】分析:电解池中离子的放电顺序和两极上发生的变化来书写电极反应方程式,并且两个电极上转移的电子数目是相等的,溶液中遵循电荷守恒.
解答:解:电解0.1LH2SO4和CuSO4的混合溶液,阳极发生的反应为:4OH-→2H2O+O2↑+4e-,阴极上发生的电极反应为:Cu2++2e-→Cu,2H++2e-→H2↑,
两极均收集到2.24L(标况)气体,即均生成0.1mol的气体,阳极生成0.1mol氧气说明转移了0.4mol电子,而阴极上生成的0.1molH2只得到了0.2mol电子,
所以剩余0.2mol电子由铜离子获得,且溶液中有0.1mol铜离子,据c=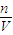 得到铜离子的浓度为:
得到铜离子的浓度为: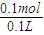 =1mol/L.
=1mol/L.
故选B.
点评:本题考查学生电解池的工作原理以及溶液中的电荷守恒思想,难度不大,明确离子放电顺序是解本题关键.
解答:解:电解0.1LH2SO4和CuSO4的混合溶液,阳极发生的反应为:4OH-→2H2O+O2↑+4e-,阴极上发生的电极反应为:Cu2++2e-→Cu,2H++2e-→H2↑,
两极均收集到2.24L(标况)气体,即均生成0.1mol的气体,阳极生成0.1mol氧气说明转移了0.4mol电子,而阴极上生成的0.1molH2只得到了0.2mol电子,
所以剩余0.2mol电子由铜离子获得,且溶液中有0.1mol铜离子,据c=
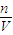 得到铜离子的浓度为:
得到铜离子的浓度为: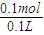 =1mol/L.
=1mol/L.故选B.
点评:本题考查学生电解池的工作原理以及溶液中的电荷守恒思想,难度不大,明确离子放电顺序是解本题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目