题目内容
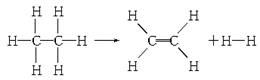
已知断裂1 mol H—H键,需要吸收热量436 kJ;断裂1 mol N≡N键,需要吸收热量946 kJ;生成1 mol N—H键,会放出热量391 kJ。试求下列反应的反应热。?N2(g)+3H2(g) ![]() 2NH3(g)??????????
2NH3(g)??????????
解析:根据反应热与化学键断裂和形成的关系,在题述反应中,有1 mol N≡N键断裂,3 mol H—H键断裂,6 mol N—H键生成。?
则有:6×391 kJ-(946 kJ+3×436 kJ)=92 kJ,该反应是放热反应,ΔH=-92 kJ·mol-1。
答案:ΔH=-92 kJ·mol-1。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
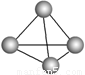
最近有科学家获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N  N放出942kJ。根据以上信息和数据,下列说法正确的是
N放出942kJ。根据以上信息和数据,下列说法正确的是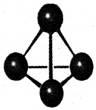
| A.N4属于一种新型的化合物 |
| B.N4与N2互为同素异形体 |
| C.N4所形成的晶体属于原子晶体 |
| D.N4气体转变为N2将吸收热量 |
 N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是