题目内容
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是I1=738kJ/mol;I2=1451kJ/mol;I3=7733kJ/mol;I4=10540kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G是第四周期中未成对电子最多的元素 |
(1)已知BA5为离子化合物,写出其电子式_____________。
(2)B基态原子中能量最高的电子,其电子云在空间有_____________个方向,原子轨道呈_____________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为![]() ,该同学所画的电子排布图违背了_____________。
,该同学所画的电子排布图违背了_____________。
(4)G位于_____________族_____________区,价电子排布式为____。
(5)DE3是________分子(填“极性”或“非极性”),中心原子的杂化方式为_________________,用价层电子对互斥理论推测其空间构型为_________________
(6)检验F元素的方法是____,请用原子结构的知识解释产生此现象的原因是_____________。
【答案】 3 哑铃 泡利原理 第ⅥB d 3d54s1 极性 sp3 三角锥形 焰色反应 电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量
3 哑铃 泡利原理 第ⅥB d 3d54s1 极性 sp3 三角锥形 焰色反应 电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量
【解析】
A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,则A为H元素; B元素原子的核外p电子数比s电子数少1,且B是短周期元素,如果B是第三周期元素,则不可能出现p电子比s电子少1,则B为第二周期元素,为N元素;C的原子序数大于B且为短周期元素,根据C的电离能知,C属于第ⅢA族元素,为Al元素;D原子核外所有p轨道全满或半满且为短周期主族元素,原子序数大于C,则D是P元素;E元素的主族序数与周期数的差为4,且E为短周期主族元素,E的原子序数大于D,则E是Cl元素;F是前四周期中电负性最小的元素,即为最活泼的金属元素,为K元素;G是第四周期中未成对电子最多的元素,则为Cr元素,再结合原子的结构和性质分析解答。
(1) NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2) B为N元素,核外电子排布式为1s22s22p3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈哑铃形,故答案为:3;哑铃;
(3) C是Al元素,根据构造原理知,其原子核外电子排布图为:![]() ,泡利不相容原理是指每个原子轨道最多只能容纳两个自旋状态不同的电子,故答案为:泡利原理;
,泡利不相容原理是指每个原子轨道最多只能容纳两个自旋状态不同的电子,故答案为:泡利原理;
(4) G为Cr,24号元素,基态原子核外电子排布式为[Ar]3d54s1,则价电子排布式为:3d54s1;位于第四周期第ⅥB族,最后填充的为d电子,为d区元素;故答案为:第ⅥB;d;3d54s1;
(5) PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥,正负电荷的重心不重合,则为极性分子,故答案为:极性;sp3;三角锥;
(6) 钾元素的检验方法为焰色反应,焰色反应的原理是:电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量,故答案为:焰色反应;电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】重铬酸钾别名为红矾钾,室温下为橙红色晶体,溶于水,不溶于乙醇。它被国际癌症研究机构划归为第一类致癌物质,而且是强氧化剂,在实验室和工业中都有很广泛的应用。实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。相关资料如下:
序号 | 资料 |
① | Cr2(SO4)3溶液呈绿色 |
② | 酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2 |
③ | CrO5可溶于水,易溶于乙醚得到蓝色溶液 |
④ | 乙醚是一种无色不溶于水,密度比水小的有机溶剂,化学性质稳定 |
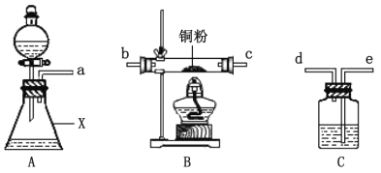
甲同学采用如图装置进行实验,探究了酸性条件下K2Cr2O7溶液和H2O2溶液的反应产物,实验步骤、操作等内容如下:
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装仪器 | —— |
Ⅱ | ? | —— |
Ⅲ | 向盛有H2O2溶液的仪器X中加入一定量的K2Cr2O7溶液和硫酸 | 溶液立即变为紫红色,此时pH=1,观察到溶液中持续产生气泡,最终溶液变为绿色 |
回答下列问题:
(1)用以上装置证明实验中产生的气体有氧气,装置的连接顺序是a→__→__→__→__。
(2)图中仪器X的名称是___。
(3)实验步骤Ⅱ是___。
(4)实验中紫红色溶液含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是___。
②已知CrO5的结构式为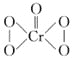 ,生CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
,生CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
(5)对上述实验中产生氧气、溶液变为绿色的原因,做出的假设①是CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。你还能做出的假设②是___。
(6)设计实验,选择合适的试剂,验证(5)中的假设①,你的设计是___。
【题目】下图是元素周期表的一部分:
C | N | O | F | ||
Si | P | S | Cl | ||
Ge | As | Se | Br | ||
Sn | Sb | Te | I | ||
Pb | Bi | Po | At | ||
![]() 阴影部分元素的外围电子排布式的通式为____。Sb的元素名称为____。基态P原子中,电子占据的最高能级符号为____,该能层具有的原子轨道数为____。
阴影部分元素的外围电子排布式的通式为____。Sb的元素名称为____。基态P原子中,电子占据的最高能级符号为____,该能层具有的原子轨道数为____。
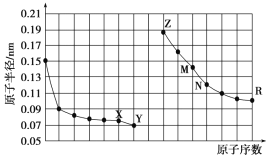
![]() 氮族元素氢化物
氮族元素氢化物![]() 、
、![]() 、
、![]() 的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物
的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物![]() 性质可能有____。
性质可能有____。
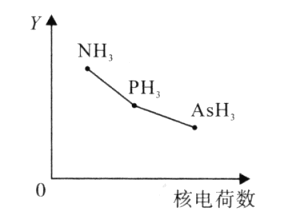
A.稳定性
B.沸点
C.![]() 键能
键能
D.分子间作用力
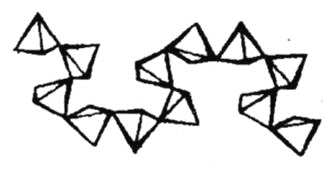
![]() 某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有____种。
某种新型储氧材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有____种。

![]() 和
和![]() 、
、![]() 及
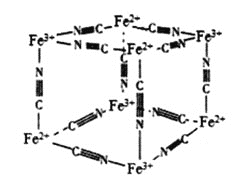
及![]() 能形成一种蓝色配位化合物普鲁士蓝。如图是该物质的结构单元
能形成一种蓝色配位化合物普鲁士蓝。如图是该物质的结构单元![]() 未标出
未标出![]() ,该图是普鲁士蓝的晶胞吗?____
,该图是普鲁士蓝的晶胞吗?____![]() 填“是”或“不是”
填“是”或“不是”![]() ,平均每个结构单元中含有____个
,平均每个结构单元中含有____个![]() 。
。
![]() 磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是
磷酸盐与硅酸盐之间具有几何形态的相似性。如多磷酸盐与多硅酸盐一样,也是通过四面体单元通过共用顶角氧离子形成岛状、链状、层状、骨架网状等结构型式。不同的是多硅酸盐中是![]() 四面体,多磷酸盐中是
四面体,多磷酸盐中是![]() 四面体。下图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为____。
四面体。下图为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为____。