题目内容
室温下,有下列四种溶液:①0.1 mol·L-1氨水
②0.1 mol·L-1NH4Cl溶液
③0.2 mol·L-1盐酸与0.2 mol·L-1 NH4Cl溶液等体积混合
④0.2 mol·L-1NaOH溶液与0.2 mol·L-1氨水等体积混合
四种溶液中c(![]() )由大到小排列正确的是( )
)由大到小排列正确的是( )
A.②③④① B.④①②③ C.①④②③ D.③②①④
D
解析:本题综合考查了弱电解质的电离,盐类水解两大平衡体系受外界因素影响发生移动引发的离子浓度大小比较,解决此类题目,首先分析溶液成分。④中0.2 mol·L-1NaOH溶液与0.2 mol·L-1氨水等体积混合后溶液成分为等浓度的氨水和氢氧化钠的混合液;氨水中存在NH3·H2O![]() OH-+
OH-+![]() 电离平衡体系;向氨水中加入氢氧化钠抑制氨水电离;NH4Cl是强电解质,完全电离,溶液中c(
电离平衡体系;向氨水中加入氢氧化钠抑制氨水电离;NH4Cl是强电解质,完全电离,溶液中c(![]() )大于等浓度的氨水中的c(
)大于等浓度的氨水中的c(![]() )。向氯化氨溶液中加入盐酸抑制铵根离子水解,使c(
)。向氯化氨溶液中加入盐酸抑制铵根离子水解,使c(![]() )增大。所以D正确。
)增大。所以D正确。

 53随堂测系列答案
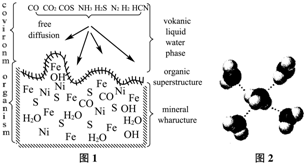
53随堂测系列答案(16分)炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结合时 生成剧毒的HCN。完成下列问题:
生成剧毒的HCN。完成下列问题:
(1)HCN的水溶液酸性很弱,则HCN电离方程式为_________________,NaCN的水溶液呈碱性是因为_________________(用离子方程式表示)。
(2)室温下,如果将0.2mol NaCN和0.1mol HCl全部溶于水,形成混合溶液(假设无损失),①__ _和_ __两种粒子的物质的量之和等于 0.2mol。②_ __和_ __两种粒子的物质的量
0.2mol。②_ __和_ __两种粒子的物质的量 之和比H+多0.1mol。
之和比H+多0.1mol。
(3)已知某溶液中只存在OH-、H+、Na+、CN-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
| A.c(CN-)>c(Na+)>c(H+)>c(OH-) | B.c(Na+)>c(CN-)>c(OH-)>c(H+) |
| C.c(CN-)>c(H+)>c(Na+)>c(OH-) | D.c(CN-)>c(Na+)>c(OH-)>c(H+) |
②若上述关系中C是正确的,则溶液中溶质的化学式是_ _和_ 。
③若该溶液中由体积相等的稀HCN溶液和NaOH溶液混合而成,且恰好呈中性,则混合前
c(HCN) c(NaOH)(填“>”、“<”、或“=”下同),
混合后溶液中c(Na+)与c(CN-)的关系c(Na+) c(CN-)。
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.