题目内容
3.已知某AB2分子的构型为V型,则( )| A. | A原子不可能是sp杂化 | B. | A原子不可能是sp2杂化 | ||
| C. | A原子不可能是sp3杂化 | D. | 不可能是极性分子 |
分析 根据价层电子对互斥理论来分析解答,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a表示中心原子的价电子数,x指与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数,氢为1.
A.分子中心原子是sp杂化说明中心原子含有2个σ键且不含孤电子对;
B.采用sp2杂化,含有3个σ键,或含有2个σ键和1个孤电子对;
C.价层电子对是4,含有2个孤电子对,A原子是sp3杂化;
D.分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子.
解答 解:A.采用sp杂化,含有2个σ键且不含孤电子对,AB2分子其空间构型为直线形,所以AB2分子的构型为V型,A原子不可能是sp杂化,故A正确;
B.二氧化硫分子中价层电子对=2+1=3,含有2个σ键和1个孤电子对,采用sp2杂化,分子构型为V形,所以A原子可能是sp2杂化,故B错误;
C.OF2分子中价层电子对=2+2=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体,该分子中含有2个孤电子对,所以其空间构型为V形,故C错误;
D.二氧化硫分子,分子构型为V形,电荷的分布是不均匀的,不对称的,为极性分子,故D错误;
故选A.
点评 本题考查了微粒空间构型的判断,题目难度中等,注意理解价层电子对理论与杂化轨道理论判断分子构型.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列实验中,若加入或通入的试剂过量,没有沉淀生成的是( )
| A. | 将SO2通入石灰水中 | B. | 将CO2通入饱和纯碱溶液中 | ||
| C. | 将CO2通入水玻璃中 | D. | 将H2S通入CuSO4溶液中 |
11.为了使硫化钠溶液中的c(Na+)≈2c(S2-),应该对硫化钠溶液采取的措施是( )
| A. | 加入少量盐酸 | B. | 加入少量氢氧化钾 | ||
| C. | 加入少量氯化铜 | D. | 升高温度 |
8.生活中的一些问题常涉及到化学知识,下列叙述正确的是( )
| A. | 苯、汽油、无水乙醇都是纯净物 | |
| B. | 甘油易溶于水,可用于制炸药TNT | |
| C. | 福尔马林和苯酚都是良好的杀菌剂,都可用于饮用水及环境消毒 | |
| D. | 室内装饰材料中缓慢释放出的甲醛、苯等有机物会污染空气 |
12.下列说法中不正确的是( )
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、纤维素都能为人体的生命活动提供能量 | |
| D. | 皮肤沾上浓HNO3后显黄色是由于浓硝酸与蛋白质发生了颜色反应 |
13.下列离子方程式正确的是( )
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{水浴加热}{→}$CH3COO--+NH4++3NH3+2Ag↓+H2O |
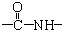 、一个
、一个 、一个
、一个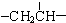 ,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为:
,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为: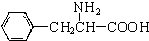 ,另一种水解产物结构简式为:CH3CH(NH2)COOH;
,另一种水解产物结构简式为:CH3CH(NH2)COOH;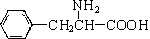 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(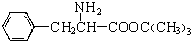 )和CH3OH,则醇X的结构简式为(CH3)3COH.
)和CH3OH,则醇X的结构简式为(CH3)3COH.