题目内容
3. 丙二烯(H2C=C=CH2)是重要的基础有机化学原料,可由 FeCl3 催化格氏试剂与甲基丁炔氯制备.
丙二烯(H2C=C=CH2)是重要的基础有机化学原料,可由 FeCl3 催化格氏试剂与甲基丁炔氯制备.(1)Fe3+基态核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5.
(2)H2C=C=CH2分子中四个氢原子是否在同一平面内:不在(填:“在”或“不在”);丙二烯中碳原子杂化轨道的类型有sp2、sp;1molH2C=C=CH2中含σ键的数目为6mol或6×6.02×1023.
(3)丙二烯遇重金属盐会爆燃生成CO和CO2,与CO2互为等电子体的阴离子为SCN-(或OCN-、CNS-、CN2-、N3-)(举一例).
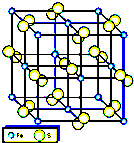
(4)铁的一种硫化物是制备FeCl3的原料,该硫化物晶胞结构如图,其化学式为FeS2.
分析 (1)Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
(2)丙二烯中中间碳原子上两个碳碳双键不共面,结合乙烯结构确定四个H原子是否共面;根据价层电子对互斥理论判断C原子杂化方式;1个丙二烯分子中含有6个σ键;
(3)原子个数相等、价电子数相等的微粒互为等电子体;
(4)该晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,S原子个数=(1+12×$\frac{1}{4}$)×2=8,根据原子个数确定化学式.
解答 解:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为:[Ar]3d5或1s22s22p63s23p63d5,
故答案为:[Ar]3d5或1s22s22p63s23p63d5;
(2)丙二烯中中间碳原子上两个碳碳双键不共面,结合乙烯结构知,四个H原子不共面;该分子中连接H原子的C原子价层电子对个数是3,为sp2杂化;中间碳原子价层电子对个数是2,为sp杂化;1个丙二烯分子中含有6个σ键,所以1molH2C=C=CH2中含σ键的数目为6mol或6×6.02×1023,
故答案为:不在;sp2、sp;6mol或6×6.02×1023;
(3)原子个数相等、价电子数相等的微粒互为等电子体,二氧化碳分子中原子个数是3、价电子数是16,与二氧化碳互为等电子体的阴离子有SCN-(或OCN-、CNS-、CN2-、N3-),
故答案为:SCN-(或OCN-、CNS-、CN2-、N3-);
(4)该晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,S原子个数=(1+12×$\frac{1}{4}$)×2=8,Fe和S原子个数之比=4:8=1:2,所以其化学式为FeS2,故答案为:FeS2.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、等电子体、原子核外电子排布等知识点,难点是等电子体判断,易错点是(2)中H原子是否共面,要根据中间C原子成键特点判断,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | Na2O2可作为潜艇工作人员的供氧剂 | |
| B. | 电解熔融NaCl可制得Na单质 | |
| C. | Fe3O4通常作为油漆原料 | |
| D. | 可用Ba(OH)2溶液区别NaHCO3溶液和Na2CO3溶液 |
| A. | 二氟化氧分子电子式: | |
| B. | 质子数与中子数相等的硫原子${\;}_{16}^{16}$S | |
| C. | 镁离子的结构示意图: | |
| D. | 对甲基苯酚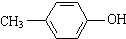 |
| A. | 铁碳合金发生电化腐蚀时,电子由碳流向铁 | |
| B. | 6NO(g)+4NH3(g)═5N2(g)+6H2O(l)常温下能自发进行,则该反应△H>0 | |
| C. | 常温下,用水稀释0.1mol•L-1NH4Cl溶液,则$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})•(O{H}^{-})}$的值不变 | |
| D. | 对于溴乙烷的水解反应(△H>0),加入NaOH 并加热,该反应的反应速率和平衡常数均增大 |
| A. | 1.6g | B. | 0.32g | C. | 3.2g | D. | 6.4g |
| A. | 溶液中只有气体产生 | |
| B. | 溶液中只有沉淀产生 | |
| C. | 溶液中有反应:Ca2++OH-+HCO-3═CaCO3↓+H2O发生 | |
| D. | 溶液中有反应:Ca2++2OH-+2HCO-3═CaCO3↓+CO32-+2H2O发生 |
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)═C(石墨)△H=-1.9kJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
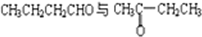 B.
B.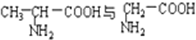 C.
C.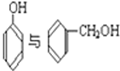 D.CH3CH2C≡CH与CH2═CH-CH═CH2E.
D.CH3CH2C≡CH与CH2═CH-CH═CH2E.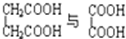 F.戊烯和戊烷
F.戊烯和戊烷 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3,名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3,名称是2-甲基戊烷.