题目内容
【题目】如图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性; F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸.请回答下列问题: 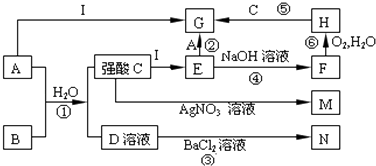
(1)写①的化学方程式
(2)写反应②的离子方程式 ﹣
(3)写出将A通入石灰乳的化学方程式
(4)在①②③④⑤⑥中,属于氧化还原反应的有:(填编号)
(5)F很不稳定,露置在空气中容易被氧化为H,该反应的化学方程式为 保存 E溶液时应加入少量的
(6)检验G溶液中阳离子的方法:(写出加入试剂的化学式和现象)
【答案】
(1)SO2+Cl2+2H2O=H2SO4+2HCl
(2)2Fe2++Cl2=2Fe3++2Cl
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(4)①②⑥
(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3;铁粉
(6)KSCN溶液,变红
【解析】解:A和B常温下都是气体,且水溶液都有漂白性,A应为Cl2,B应为SO2,M和N不溶于稀硝酸,可知M为AgCl,N为BaSO4,则C为HCl,D为H2SO4,由转化关系可知I为Fe,E为FeCl2,F为Fe(OH)2,H为Fe(OH)3,G为FeCl3,(1)二氧化硫和氯气在溶液中发生氧化还原反应生成硫酸和盐酸,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
所以答案是:SO2+Cl2+2H2O=H2SO4+2HCl;(2)反应②的离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣,所以答案是:2Fe2++Cl2=2Fe3++2Cl﹣;(3)氯气和氢氧化钙反应生成氯化钙和次氯酸钙,方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,所以答案是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;(4)反应①中Cl元素的化合价降低,S元素的化合价降低,反应②中Cl元素的化合价降低,Fe元素的化合价升高,反应⑥中Fe元素的化合价升高,O元素的化合价降低,而其他反应中没有元素的化合价变化,所以①②⑥属于氧化还原反应,所以答案是:①②⑥;(5)反应⑥的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,亚铁离子具有还原性,易被空气中氧气氧化,可加入铁粉防止被氧化,
所以答案是:4Fe(OH)2+O2+2H2O=4Fe(OH)3;铁粉;(6)铁离子可与KSCN反应,溶液变红色,所以答案是:KSCN溶液,变红.