题目内容
【题目】向盛有10mL1molL﹣1 NH4Al(SO4)2溶液的烧杯中滴加1molL﹣1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下: 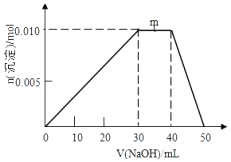
①写出m点反应的离子方程式: .
②若10mL1molL﹣1 NH4Al(SO4)2溶液中改加20mL1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol(列式计算)
【答案】NH4++OH﹣=NH3?H2O;0.022
【解析】解:①由图可知0mL~30mL,发生反应Al3++3OH﹣=Al(OH)3↓,氢氧化铝沉淀逐渐增多,m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为:NH4++OH﹣=NH3H2O,40mL~50mL是氢氧化铝逐渐溶解,
所以答案是:NH4++OH﹣=NH3H2O;
②10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,
由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4,
Al3++ | 3OH﹣= | Al(OH)3↓ |
0.01mol | 0.03mol | 0.01mol |
反应剩余OH﹣为0.048mol﹣0.03mol=0.018mol,
NH4++ | OH﹣=NH3H2O |
0.01mol | 0.01mol |
反应剩余OH﹣为0.018mol﹣0.01mol=0.008mol,
Al(OH)3+ | OH﹣=AlO2﹣+2H2O |
0.008mol | 0.008mol |
故得到Al(OH)3沉淀为0.01mol﹣0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
所以答案是:0.022.