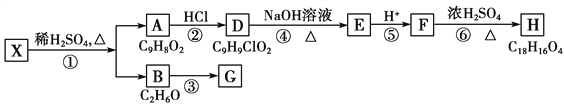
题目内容
【题目】已知:25℃,H2A的电离常数Kl=6.0×10-2,K2=6.0×10-5。此温度下,将1 mL浓度为0.1mol/L, 的H2A溶液加水稀释到1000mL。下列说法正确的是
A. 上述稀释过程中,H2A分子及所有离子浓度均减小
B. 上稀释过程中,![]() 的变化趋势保持增大
的变化趋势保持增大
C. 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-)
D. 根据H2A的电离常数,可推知0.1mol/L NaHA溶液的pH值大于7
【答案】B
【解析】A.稀释过程中H+溶液减小,Kw不变,则OH-浓度增大,故A错误;B.稀释过程中,![]() =
=![]() ×
×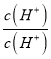 =
=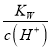 ,H+溶液减小,Kw不变,则
,H+溶液减小,Kw不变,则![]() 的变化趋势保持增大,故B正确;C.H2A是强酸,不可能完全电离,且第一步电离是主要的,溶液中c(H+)=c(OH-)+2c(A2-)+c(HA-),故C错误;D. NaHA溶液中HA-+H2O
的变化趋势保持增大,故B正确;C.H2A是强酸,不可能完全电离,且第一步电离是主要的,溶液中c(H+)=c(OH-)+2c(A2-)+c(HA-),故C错误;D. NaHA溶液中HA-+H2O![]() H2A+OH-,Kh=
H2A+OH-,Kh=![]() =
=![]() ×10-12<6.0×10-5,即在0.1mol/L NaHA溶液中HA-的水解小于其电离,溶液显酸性,溶液的pH值小大于7,故D错误;答案为B。
×10-12<6.0×10-5,即在0.1mol/L NaHA溶液中HA-的水解小于其电离,溶液显酸性,溶液的pH值小大于7,故D错误;答案为B。

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目