题目内容
(1)下列物质中:①NaCl溶液 ②氢氧化钠 ③二氧化碳 ④氯化氢 ⑤水 ⑥酒精,属于电解质的是
(2)写出下列物质间反应的离子反应方程式:
①硫酸氢钠和氢氧化钠溶液
②硝酸银溶液与氯化钾溶液
③醋酸(CH3COOH)和氨水
②④⑤
②④⑤
;非电解质的是③⑥
③⑥
;弱电解质的是⑤
⑤
.(请用序号填空)(2)写出下列物质间反应的离子反应方程式:
①硫酸氢钠和氢氧化钠溶液
H++OH-=H2O
H++OH-=H2O
;②硝酸银溶液与氯化钾溶液
Ag++Cl-=AgCl↓
Ag++Cl-=AgCl↓
;③醋酸(CH3COOH)和氨水
CH3COOH+NH3?H2O=CH3COO-+NH4++H2O
CH3COOH+NH3?H2O=CH3COO-+NH4++H2O
.分析:(1)电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质在水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;非电解质是指:在熔融状态和水溶液中都不能导电的化合物;单质,混合物既不是电解质也不是非电解质;弱电解质是在水溶液中或熔融状态下部分电离的电解质,据此即可解答.
(2)①硫酸氢钠电离出的氢离子和氢氧化钠电离出的氢氧根离子反应生成水;
②硝酸银溶液与氯化钾溶液反应生成氯化银沉淀和硝酸钾;
③醋酸和氨水反应生成醋酸根离子和铵根离子、水;
(2)①硫酸氢钠电离出的氢离子和氢氧化钠电离出的氢氧根离子反应生成水;
②硝酸银溶液与氯化钾溶液反应生成氯化银沉淀和硝酸钾;
③醋酸和氨水反应生成醋酸根离子和铵根离子、水;
解答:解:(1)①NaCl溶液中有自由移动的钠离子和氯离子能导电,但它是混合物,电解质必须是化合物,所以它既不是电解质也不是非电解质;
②氢氧化钠在水溶液中或熔融状态下,能完全电离出自由移动的钠离子和氢氧根离子,能导电;它是化合物,属于强电解质;
③二氧化碳只存在分子,没有自由移动的离子,所以不能导电;二氧化碳在水溶液中与水反应生成碳酸,碳酸电离出自由移动的离子导电,二氧化碳自身不能电离,二氧化碳是非电解质;
④氯化氢,只存在分子,没有自由移动的离子,所以不能导电;溶液中能完全电离出自由移动的氯离子和氢离子,所以,它是强电解质;
⑤水只能部分电离出氢离子和氢氧根离子,电离方程式为H2O?H++OH-,是弱电解质;
⑥酒精,是化合物,但其水溶液只存在乙醇分子,不导电,属于非电解质;
故答案为:②④⑤;③⑥;⑤;
(2)①硫酸氢钠电离NaHSO4=Na++H++SO42-,电离出的氢离子和氢氧化钠电离NaOH=Na++OH-电离出的氢氧根离子反应生成水,离子反应方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
②氯化钾与硝酸银溶液反应生成氯化银沉淀和硝酸钾,反应的化学方程式为:KCl+AgNO3=AgCl↓+KNO3,硝酸银电离出的银离子和氯化钾电离出的氯离子反应生成氯化银沉淀,氯化银在离子反应中应保留化学式,
离子反应方程式为:Ag++Cl-=AgCl↓,
故答案为:Ag++Cl-=AgCl↓;
③醋酸(CH3COOH)和氨水反应生成醋酸铵和水,电离出醋酸根离子和铵根离子、水,乙酸为弱酸
应保留化学式,氨水为弱碱,应保留化学式,离子反应方程式为:CH3COOH+NH3?H2O=CH3COO-+NH4++H2O,
故答案为:CH3COOH+NH3?H2O=CH3COO-+NH4++H2O;
②氢氧化钠在水溶液中或熔融状态下,能完全电离出自由移动的钠离子和氢氧根离子,能导电;它是化合物,属于强电解质;
③二氧化碳只存在分子,没有自由移动的离子,所以不能导电;二氧化碳在水溶液中与水反应生成碳酸,碳酸电离出自由移动的离子导电,二氧化碳自身不能电离,二氧化碳是非电解质;
④氯化氢,只存在分子,没有自由移动的离子,所以不能导电;溶液中能完全电离出自由移动的氯离子和氢离子,所以,它是强电解质;
⑤水只能部分电离出氢离子和氢氧根离子,电离方程式为H2O?H++OH-,是弱电解质;
⑥酒精,是化合物,但其水溶液只存在乙醇分子,不导电,属于非电解质;
故答案为:②④⑤;③⑥;⑤;
(2)①硫酸氢钠电离NaHSO4=Na++H++SO42-,电离出的氢离子和氢氧化钠电离NaOH=Na++OH-电离出的氢氧根离子反应生成水,离子反应方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
②氯化钾与硝酸银溶液反应生成氯化银沉淀和硝酸钾,反应的化学方程式为:KCl+AgNO3=AgCl↓+KNO3,硝酸银电离出的银离子和氯化钾电离出的氯离子反应生成氯化银沉淀,氯化银在离子反应中应保留化学式,
离子反应方程式为:Ag++Cl-=AgCl↓,
故答案为:Ag++Cl-=AgCl↓;
③醋酸(CH3COOH)和氨水反应生成醋酸铵和水,电离出醋酸根离子和铵根离子、水,乙酸为弱酸
应保留化学式,氨水为弱碱,应保留化学式,离子反应方程式为:CH3COOH+NH3?H2O=CH3COO-+NH4++H2O,
故答案为:CH3COOH+NH3?H2O=CH3COO-+NH4++H2O;
点评:本题考查电解质的概念、离子方程式的书写,注意电解质和非电解质都必须是化合物,弱电解质部分电离,注意物质的性质,注意离子方程式的书写方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
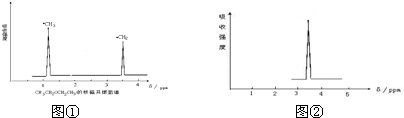

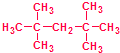
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖. ③白磷 ④氯气
③白磷 ④氯气 ⑥氯水 ⑦12C
⑥氯水 ⑦12C 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.