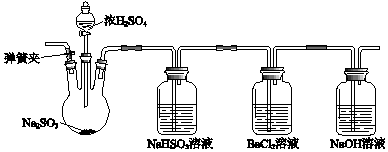
题目内容
【题目】在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O 中
(1)用单线桥标出电子转移
(2)还原剂是 , 被还原的元素是 , 还原产物是 .
(3)若生成2mol的NO气体,溶液中生成的Cu2+为mol.
(4)在反应中硝酸显示性和性.
【答案】
(1)![]() =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O
(2)Cu; N; NO
(3)3
(4)酸;氧化
【解析】解:(1)该反应中铜元素的化合价变化为0价→+2价,氮元素的化合价变化为+5价→+4价,所以得失电子的最小公倍数是2,所以其电子转移的方向和数目为 ![]() =3Cu(NO3)2+2NO↑+4H2O,
=3Cu(NO3)2+2NO↑+4H2O,
所以答案是: ![]() =3Cu(NO3)2+2NO↑+4H2O;(2)铜元素的化合价升高,Cu是还原剂,氮元素的化合价降低,硝酸被还原,NO为还原产物;
=3Cu(NO3)2+2NO↑+4H2O;(2)铜元素的化合价升高,Cu是还原剂,氮元素的化合价降低,硝酸被还原,NO为还原产物;
所以答案是:Cu;N;NO;(3)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O中,若生成2mol的NO气体,溶液中生成的Cu2+为3mol;
所以答案是:3;(4)N元素的化合价降低,则HNO3为氧化剂,硝酸表现氧化性,反应生成硝酸铜,硝酸表现酸性;
所以答案是:酸;氧化.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目