题目内容
含有下列各组离子的溶液中,通入过量SO2气体后仍能大量共存的是
| A.H+、Ca2+、Fe3+、NO3- | B.Ba2+、ClO-、Na+、OH- |
| C.Na+、NH4+、I-、HS- | D.Na+、Ca2+、K+、Cl- |
D
解析试题分析:离子间如果发生化学反应则不能大量共存,反之是可以的。A、四种离子可以大量共存,但通入SO2后硝酸能氧化SO2,不能大量共存,A不正确;B、四种离子可以大量共存,但通入SO2后次氯酸根氧化SO2,进而生成硫酸钡沉淀,不能大量共存,B不正确;C、四种离子可以大量共存,但通入SO2后与HS-反应生成单质硫,不能大量共存,C不正确;D、四种离子均与SO2不反应,可以大量共存,D正确,答案选D。
考点:考查离子共存以及SO2的性质

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- |
| B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl- |
| C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3- |
| D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42- |
下列离子方程式不正确的是
| A.过量的NaHSO4和Ba(OH)2溶液反应:2H++SO42—+Ba2++2OH—= BaSO4↓+2H2O |
| B.NH4HCO3和过量NaOH溶液相混合:HCO3—+OH—=CO32—+H2O |
| C.NaHSO4溶液中滴加氨水:H++NH3·H2O=NH4++H2O |
| D.向氨水中通入过量的SO2:NH3·H2O+SO2=NH4++HSO3— |
下列物质属于电解质的是
| A.硫酸氢钠 | B.铜 | C.氯气 | D.氨 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 NaHSO4溶液:K+、Fe2+、NO3-、Cl- |
| B.0.1 mol·L-1NaAlO2的溶液:K+、Na+、SO42-、CO32- |
| C.无色溶液:Ba 2+、Na+、MnO4-、NO3- |
| D.由水电离出的c(OH-)=1.0×10-12 mol·L-1的溶液:NH4+、HCO3-、Na+、Cl- |
根据表中信息,判断下列叙述中正确的是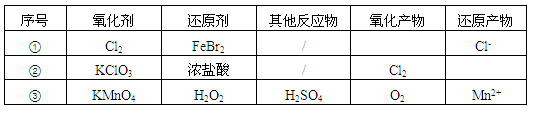
| A.表中①组的反应只可能有一种元素被氧化和一种元素被还原 |
| B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2 |
| C.由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存 |
| D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O |
能正确表示下列反应的离子方程式为
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH–= CO32-+ H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2+ ClO- + 2OH–= SO42-+Cl-+ H2O |
| C.硫化钡加入稀硫酸:BaS+ 2H+ = H2S↑+ Ba2+ |
| D.新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH–=2AlO2–+H2O |
在水溶液中能大量共存的一组是( )
| A.Ba2+、Na+、SO42-、Cl- |
| B.MnO4-、SO32-、H+、K+ |
| C.AlO2-、Mg2+、K+、HCO3- |
| D.K+、Na+、NO3-、SO42- |
25°C下列各组间一定能大量共存的是
| A.pH=1的溶液:Na+、CO32-、Cl-、Ca2+ |
| B.水电离的c(H+)=1.0×10-13的溶液:K+、HCO3-、SO42-、NH4+ |
| C.c(OH-)/c(H+)=1.0×10—12的溶液:Fe2+、NO3-、K+、Cl- |
| D.含有Ba2+离子溶液:AlO2-、Na+、NO3-、NH4+ |