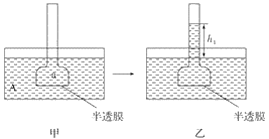
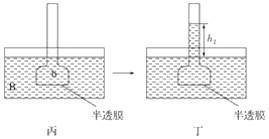
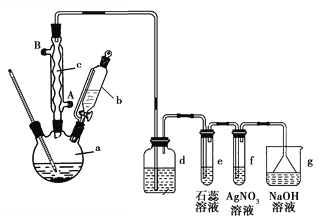
题目内容
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、天平、药匙、______、______。
(2)写出Na2SO3固体氧化变质的化学方程式__________。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是________,在过滤前,需要检验是否沉淀完全,其操作是_______。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果_______(填“偏高”或“偏低”)。
(5)若操作正确,结果为m1<m2,试分析原因是___________。
(6)取25.00 mL上述溶液,用c mol/L酸性KMnO4溶液滴定测定Na2SO3的纯度,已知酸性条件下,KMnO4通常被还原为Mn2+,滴定达到终点时的现象为____________。
【答案】胶头滴管 250 mL容量瓶 2Na2SO3+O2=2Na2SO4 使![]() 充分转化为气体 静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成 偏高 方案Ⅱ中盐酸提供的H+与Ba(NO3)2提供的
充分转化为气体 静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成 偏高 方案Ⅱ中盐酸提供的H+与Ba(NO3)2提供的![]() 形成稀HNO3,将一部分
形成稀HNO3,将一部分![]() 氧化成
氧化成![]() ,导致BaSO4质量增大 当滴加最后一滴标准液时,溶液由无色刚好变为浅红色,且半分钟不褪色
,导致BaSO4质量增大 当滴加最后一滴标准液时,溶液由无色刚好变为浅红色,且半分钟不褪色
【解析】
(1)配制250 mL Na2SO3溶液时,用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、天平、250 mL容量瓶;
(2)Na2SO3固体氧化变质生成Na2SO4;
(3)根据BaSO4是不溶于酸的固体物质,而BaSO3不溶于水,但能够与酸反应产生SO2气体逸出;![]() 完全沉淀时,上层清液没有
完全沉淀时,上层清液没有![]() ,再加入氯化钡溶液也不会有沉淀生成;
,再加入氯化钡溶液也不会有沉淀生成;
(4)方案I中,若滤液浑浊,说明滤液中含有硫酸钡,导致沉淀硫酸钡的质量偏小,计算出的样品中硫酸钠的质量偏小;
(5)酸性条件下,H+、![]() 将
将![]() 氧化为
氧化为![]() ,导致BaSO4质量增大;
,导致BaSO4质量增大;
(6)根据KMnO4溶液显紫色,反应产生的Mn2+水溶液显无色来判断滴定终点。
(1)用天平称量一定质量的固体物质,要用到天平、药匙,在烧杯中溶解药品,并用玻璃棒不断搅拌,将冷却后的溶液用玻璃棒引流移入250 mL容量瓶中,再加水定容,当液面至离刻度线1~2 cm处,改用胶头滴管定容,故缺少的仪器是250 mL容量瓶、胶头滴管;
(2)Na2SO3具有还原性,容易被氧气氧化产生Na2SO4,反应方程式为:2Na2SO3+O2=2Na2SO4;
(3)方案I是利用生成的BaSO4沉淀计算样品中Na2SO4的质量,然后再计算Na2SO3的纯度,但Na2SO3也会与BaCl2反应生成BaSO3白色沉淀,而影响BaSO4质量的测定,因此需要除去Na2SO3,加入过量的盐酸酸化的BaCl2溶液,目的是:使![]() 与盐酸充分转化为SO2气体。在过滤前,需要检验
与盐酸充分转化为SO2气体。在过滤前,需要检验![]() 是否沉淀完全,其操作是:静置,向上层清液中再滴入BaCl2溶液,观察是否继续有沉淀生成。若有沉淀生成,说明
是否沉淀完全,其操作是:静置,向上层清液中再滴入BaCl2溶液,观察是否继续有沉淀生成。若有沉淀生成,说明![]() 没有沉淀完全,若无沉淀生成,证明
没有沉淀完全,若无沉淀生成,证明![]() 沉淀完全;
沉淀完全;
(4)方案I中,若滤液浑浊,说明滤液中含有BaSO4,导致沉淀BaSO4的质量偏小,由此计算出的样品中Na2SO4的质量偏小,则计算Na2SO3的质量分数就偏高;
(5)方案II中盐酸提供H+,Ba(NO3)2提供![]() ,形成稀HNO3,能够将一部分
,形成稀HNO3,能够将一部分![]() 氧化成
氧化成![]() ,导致BaSO4质量增大,所以m1<m2;
,导致BaSO4质量增大,所以m1<m2;
(6)酸性KMnO4溶液具有强的氧化性,Na2SO3具有还原性,二者在溶液中发生氧化还原反应,KMnO4溶液被还原变为无色的Mn2+,Na2SO3被氧化为Na2SO4,使KMnO4溶液由紫色变为无色。因此当溶液中Na2SO3完全被氧化变为Na2SO4时,再滴加的KMnO4溶液不能发生反应,此时溶液的紫色不再褪去,故滴定终点的判断方法是:当滴加最后一滴KMnO4标准液时,溶液恰好由无色变为浅红色,且半分钟不褪色,说明达到了滴定终点。

【题目】已知A、B、C、D、E、F、G为前四周期中的常见元素,且原子序数依次增大,A的原子半径最小;B的基态原子L层电子数是K层电子数的2倍;C与B同周期且基态原子最外层电子排布式为nsmnpm+2;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色;且D、G的原子序数相差10;E元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,且E、F的电子数相差1。
请回答下列问题:
(1)基态E原子的价电子排布式为___。
(2)与BC分子互为等电子体的离子为___ (填化学式,任写一种)。
(3)在液态非极性分子B6A6中,B原子采取的杂化方式为___。
(4)元素C的简单氢化物的沸点比同主族的简单氢化物都高的原因是___。
(5)F可形成化学式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4。向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为___。
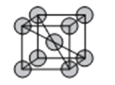
(6)金属D、G晶体的晶胞结构如图所示。
①金属G的晶胞中,测得晶胞中G原子的半径为apm,则G晶体的密度为___g/cm3(列出表达式即可,NA为阿伏伽德罗常数的值),D、G两种晶胞中金属的配位数之比为___。

②金属G、锌两种元素的笫一电离能、第二电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 |
G | 746 | 1958 |
锌 | 906 | 1733 |
G的第二电离能(I2)大于锌的第二电离能(I2),其主要原因是___。