��Ŀ����
����Ŀ��ij�����ۺϴ�����![]() ��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣���������ͼ��ʾ��
��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣���������ͼ��ʾ��

��1������1����Ҫ�ɷֳ�Ca(OH)2�⣬����____��____���ѧʽ����
��2��Ϊʹ��Ӧ���е��й����屻������գ��ɲ�ȡ�Ĵ�ʩ�У�������Ӵ��������____��
��3����֪��
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
Ϊȷ����Ӧ��ֻ����NaNO2��������Ӧ����NO��O2�����ʵ���֮��Ϊ____����ʱ��Ӧ�ܵ����ӷ���ʽΪ____����n(NO) :n(O2)=3:1����NaOH��Һ��������������Һ1��NaNO3��NaNO2�����ʵ���֮��Ϊ____��
���𰸡� CaCO3 CaSO3����CaSO4����˳��ɵߵ��� ������������� 4:1 ![]() 1:5
1:5
����������ҵ������CO2��SO2�ɱ�ʯ��ˮ���գ����ɹ���1ΪCaCO3��CaSO3������ʯ���飬����1�Dz��ܱ�����ʯ��ˮ���յ�N2��NO��CO������1ͨ����������һ������ת��Ϊ����������������������Һ������NaNO2�� NaNO2�뺬��NH4+����Һ��Ӧ���ɵ�����������2����CO��N2��������������������Ҫ��CO��
(1)������������������1����Ҫ�ɷֳ�Ca(OH)2�⣬����CaCO3��CaSO3���ʴ�Ϊ��CaCO3��CaSO3��
(2)Ϊʹ��Ӧ���е��й����屻������գ��ɲ�ȡ�Ĵ�ʩ�У�������Ӵ�������ڿ�����������ٲ�Ҫ���죬�ʴ�Ϊ��������������٣�
(3)��2NO + O2 = 2NO2����NO2+NO+2NaOH=2NaNO2+H2O������+����2��4NO + O2+4NaOH=4NaNO2+4H2O��Ϊȷ����Ӧ��ֻ����NaNO2��������Ӧ����NO��O2�����ʵ���֮��4:1����Ӧ����NO2-��NH4+��Ӧ���ɵ�������Ӧ��NO2-��NԪ�ػ��ϼ۽��ͣ�NH4+��NԪ�ػ��ϼ����ߣ�O��H���ϼ۲��䣬Ӧ������ˮ����Ӧ�����ӷ���ʽΪ![]() ����������Ϊ1mol��ʣ��1molNO������2NO + O2 = 2NO2����Ӧ����2mol NO2������NO2+NO+2NaOH=2NaNO2+H2O����Ӧ����NaNO22mol����Ӧ��ʣ��1mol NO2������2NO2+2NaOH=NaNO3+NaNO2+H2O��Ӧ����NaNO3��NaNO2��0.5mol�����NaNO3��NaNO2�����ʵ���֮��Ϊ0.5:2.5=1:5���ʴ�Ϊ��4:1��
����������Ϊ1mol��ʣ��1molNO������2NO + O2 = 2NO2����Ӧ����2mol NO2������NO2+NO+2NaOH=2NaNO2+H2O����Ӧ����NaNO22mol����Ӧ��ʣ��1mol NO2������2NO2+2NaOH=NaNO3+NaNO2+H2O��Ӧ����NaNO3��NaNO2��0.5mol�����NaNO3��NaNO2�����ʵ���֮��Ϊ0.5:2.5=1:5���ʴ�Ϊ��4:1��![]() ��1:5��
��1:5��

 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д� ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�����Ŀ��NH3��һ����Ҫ�Ļ���ԭ�ϣ�����������������;�㷺��
��1����֪��
���ۼ� | ����/ kJ��mol-1 |
H�DH | 436 |
N��N | 946 |
N�DH | 391 |
ע������̬������1 molij�ֹ��ۼ���Ҫ���յ����������Ǹù��ۼ��ļ��ܡ�
N2 (g)��3 H2 (g)![]() 2 NH3 (g) H =____kJ��mol-1
2 NH3 (g) H =____kJ��mol-1
��2��һ���¶��£�����ݵ��ܱ������г���N2��H2������Ӧ��N2 ��3H2 ![]() 2NH3����ø����Ũ����ʱ��仯��ͼ1��ʾ��
2NH3����ø����Ũ����ʱ��仯��ͼ1��ʾ��
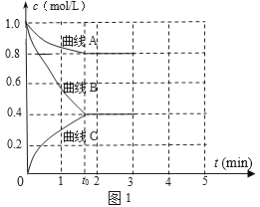
�ٱ�ʾc(N2)��������__�������A����������B��������C������
��0��t0ʱ��H2��ʾ��Ӧ����v(H2)____mol��L-1��min-1��
��������˵���÷�Ӧ�ﵽƽ�����____��
a����������ѹǿ���ٱ仯
b��2c(H2)= 3c(NH3)
c�����������������ٱ仯
d��NH3������������ٱ仯
��3��DZͧ��ʹ�õ�Һ��-Һ��ȼ�ϵ�ع���ԭ����ͼ2��ʾ��
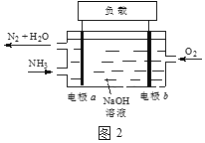
�ٵ缫b������____��
�ڵ������Һ��OH-������____�ƶ�����缫a���缫b������
�۵缫a�ĵ缫��ӦʽΪ____��
��4����ͨ��NH3��NaClO��Ӧ���Ƶû��ȼ���£�N2H4�����÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��____��


