题目内容
【题目】某研究性学习小组拟取苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴,设计了如下流程:
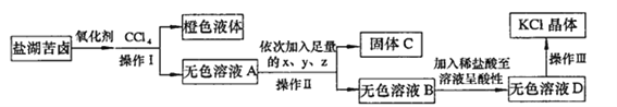
回答以下问题:
(1)操作I的名称是__________________。从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯、温度计、锥形瓶外,还需要
_________________________。
(2)试剂z的化学式为_____________;检验SO42-已除尽的方法是_____________________________。
(3)无色溶液B中加入稀盐酸至溶液呈酸性,发生反应的离子方程式为___________________。
【答案】 萃取分液 蒸馏烧瓶、冷凝管、牛角管(接引管) K2CO3 取无色溶液D少许,加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽 H++OH-=H2O、 2H++CO32-=H2O+CO2
【解析】(1)操作Ⅰ为互不相溶的液体的分离,应为萃取分液,从橙色液体中分离出溴,应为蒸馏操作,以此判断所需要的仪器;(2)除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,检验SO42-已除尽,应加入BaCl2溶液,观察是否有沉淀生成;(3)无色溶液B中主要含有过量的氢氧化钾和碳酸钾。
(1)氧化剂应为氯气,通入氯气发生:Cl2+2Br-=2Cl-+Br2,加入CCl4,溴易溶于CCl4,溶液分层,用萃取、分液的方法分离;由于溴和CCl4的沸点不同,可用蒸馏的方法分离,蒸馏时用到的仪器有酒精灯、温度计、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等;
(2)除去溶液中的Mg2+、SO42-,应分别加入过量的BaCl2、KOH、K2CO3,类似于粗盐的提纯,加入过量BaCl2可除去SO42-,加入过量KOH溶液可除去Mg2+,最后加入K2CO3可除去BaCl2,检验SO42-已除尽的方法是取无色溶液D,加入BaCl2溶液,若没有白色沉淀,则SO42-已除尽;(3)无色溶液B中主要含有过量的氢氧化钾和碳酸钾,故加入稀盐酸至溶液呈酸性,发生反应的离子方程式为H++OH-=H2O、 2H++CO32-=H2O+CO2。