题目内容
氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量).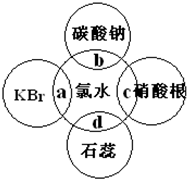
(1)能证明氯水具有漂白性的是 (填“a”、“b”、“c”或“d”).
(2)C过程中的现象是 ,b过程中的离子方程式为 (提示:酸性H2CO3>HClO>HCO3-).
(3)a过程中的化学方程式为 .
(4)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 .

(1)能证明氯水具有漂白性的是
(2)C过程中的现象是
(3)a过程中的化学方程式为
(4)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
考点:氯气的化学性质
专题:推断题
分析:将氯气溶于水得到氯水(浅黄绿色),氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的).
氯水的性质取决于其组成的微粒:
强氧化性:Cl2是新制氯水的主要成分,实验室常用氯水代替氯气,如氯水中的氯气能与KI,KBr、FeCl2、SO2、Na2SO3等物质反应.
漂白、消毒性:氯水中的Cl2和HClO均有强氧化性,一般在应用其漂白和消毒时,应考虑HClO,HClO的强氧化性将有色物质氧化成无色物质,不可逆.
酸性:氯水中含有HCl和HClO,故可被NaOH中和,盐酸还可与NaHCO3,CaCO3等反应.
不稳定性:HClO不稳定光照易分解. 沉淀反应:加入AgNO3溶液有白色沉淀生成(氯水中有Cl-),以此解答(1)-(3);
(4)ClO-与ClO3-的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,以此计算.
氯水的性质取决于其组成的微粒:
强氧化性:Cl2是新制氯水的主要成分,实验室常用氯水代替氯气,如氯水中的氯气能与KI,KBr、FeCl2、SO2、Na2SO3等物质反应.
漂白、消毒性:氯水中的Cl2和HClO均有强氧化性,一般在应用其漂白和消毒时,应考虑HClO,HClO的强氧化性将有色物质氧化成无色物质,不可逆.
酸性:氯水中含有HCl和HClO,故可被NaOH中和,盐酸还可与NaHCO3,CaCO3等反应.
不稳定性:HClO不稳定光照易分解. 沉淀反应:加入AgNO3溶液有白色沉淀生成(氯水中有Cl-),以此解答(1)-(3);
(4)ClO-与ClO3-的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,以此计算.
解答:
解:(1)氯水中的HClO有强氧化性,一般在应用其漂白时,HClO的强氧化性将有色物质氧化成无色物质,本题中氯水能使石蕊试液先变红,后褪色,故答案为:d;
(2)氯水中有Cl-,则c中加入AgNO3溶液有白色沉淀生成,生成AgCl沉淀,观察到白色沉淀;b氯水中含有HCl和HClO,具有酸性,与CO32-反应生成二氧化碳气体,发生2H++CO32-═H2O+CO2↑、HClO+CO32-=HCO3-+ClO-,
故答案为:有白色沉淀生成;2H++CO32-═H2O+CO2↑、HClO+CO32-=HCO3-+ClO-;
(3)Cl2是新制氯水的主要成分,具有强氧化性,与KBr发生氧化还原反应,反应的化学方程式为Cl2+2KBr═2KCl+Br2,故答案为:Cl2+2KBr═2KCl+Br2;
(4)ClO-与ClO3-的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,所以,被还原的氯元素与被氧化的氯元素的物质的量之比=16:(1+3)=4:1,故答案为:4:1.
(2)氯水中有Cl-,则c中加入AgNO3溶液有白色沉淀生成,生成AgCl沉淀,观察到白色沉淀;b氯水中含有HCl和HClO,具有酸性,与CO32-反应生成二氧化碳气体,发生2H++CO32-═H2O+CO2↑、HClO+CO32-=HCO3-+ClO-,
故答案为:有白色沉淀生成;2H++CO32-═H2O+CO2↑、HClO+CO32-=HCO3-+ClO-;
(3)Cl2是新制氯水的主要成分,具有强氧化性,与KBr发生氧化还原反应,反应的化学方程式为Cl2+2KBr═2KCl+Br2,故答案为:Cl2+2KBr═2KCl+Br2;
(4)ClO-与ClO3-的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,所以,被还原的氯元素与被氧化的氯元素的物质的量之比=16:(1+3)=4:1,故答案为:4:1.
点评:本题考查氯水的成分及性质,综合考查元素化合物知识,为高频考点,把握物质的性质及发生的反应为解答的关键,注意(4)中电子守恒的计算,题目难度不大.

练习册系列答案
相关题目
下列仪器的使用或操作或实验正确的是( )
| A、在“食醋总酸含量测定”实验中,将食醋稀释10倍后再滴定是为了减少食醋的浪费 |
| B、在实验室中,吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒;若受溴腐蚀致伤,先用氢氧化钠溶液洗伤口,再用酒精洗,最后水洗 |
| C、用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 |
| D、在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
下列各组微粒半径之比大于1的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|